Postępowanie z ciałami inkluzyjnymi w ekspresji białek rekombinowanych
Rekombinowane białka są najczęściej wyrażane w przestrzeni wewnątrzkomórkowej, ale ekspresja może być również kontrolowana tak, aby białko było wydzielane do przestrzeni peryplazmatycznej lub na zewnątrz do pożywki hodowlanej. Podczas gdy wydzielanie jest korzystne pod względem fałdowania białek, rozpuszczalności i wiązania disiarczkowego, wydajność jest generalnie znacznie wyższa w przypadku ekspresji wewnątrzkomórkowej.
Jednak rekombinowane białko nagromadzone wewnątrzkomórkowo często odkłada się w postaci ciałek inkluzyjnych, nierozpuszczalnych agregatów nieprawidłowo sfałdowanego białka pozbawionego aktywności biologicznej. Rekombinowane białko jest często głównym składnikiem ciałek inkluzyjnych. Przygotowanie ciał inkluzyjnych może być zatem etapem oczyszczania o istotnym znaczeniu. Izolacja białek z ciał inkluzyjnych często prowadzi jednak do trudności z ponownym formowaniem i zwykle nie zapewnia pełnego odzyskania aktywności biologicznej. Tabela 10.1 podsumowuje zalety i wady pracy z rekombinowanymi produktami wyrażonymi jako ciałka inkluzyjne. Tworzenie ciał inkluzyjnych często występuje, gdy białka eukariotyczne ulegają ekspresji w gospodarzach bakteryjnych.
| Zalety | Wady |
|---|---|
| Wysoki poziom ekspresji Ciała inkluzyjne mogą być izolowane do wysokiej czystości . Ciała inkluzyjne mogą zapewniać ochronę przed enzymami proteolitycznymi Umożliwiają ekspresję toksycznych białek | Refolding jest często kłopotliwy i nie można przewidzieć optymalnych warunków |
Jeśli białko ulega ekspresji w postaci ciałek inkluzyjnych, należy rozważyć kilka opcji: zoptymalizować w jak największym stopniu ekspresję rozpuszczalną, zaakceptować tworzenie ciałek inkluzyjnych, ale opracować strategie rozpuszczania i ponownego składania białka, wypróbować innego gospodarza ekspresji lub zmodyfikować konstrukt plazmidu. Ekspresja jako ciałka inkluzyjne może pozwolić na ekspresję białek, które są toksyczne dla komórki gospodarza.
Optymalizacja dla ekspresji rozpuszczalnej
Przyczyny powstawania ciałek inkluzyjnych nie są dobrze poznane. Wiadomo jednak, że zmniejszona szybkość wzrostu zwykle prowadzi do bardziej rozpuszczalnej ekspresji, a tym samym zmniejsza tendencję do tworzenia ciałek inkluzyjnych.
Kilka prostych modyfikacji warunków hodowli, mających na celu zmniejszenie szybkości wzrostu i/lub szybkości ekspresji, jest zatem wartych rozważenia w celu optymalizacji rozpuszczalnej ekspresji. Wadą jest to, że ogólna wydajność rekombinowanego białka może również ulec zmniejszeniu.
Zmniejszoną szybkość wzrostu można osiągnąć poprzez obniżenie temperatury wzrostu do między 20 °C a 30 °C.
W przypadku białek, które są wyrażane pod kontrolą indukowalnego promotora, szybkość ekspresji można również zmniejszyć, zmieniając warunki indukcji:
- indukuj przy niższej gęstości komórek (A600 = 0.5)
- indukować przez krótszy okres czasu
- indukować przy użyciu niższego stężenia czynnika indukującego (np, 0,1 mM IPTG)
Jeśli te modyfikacje okażą się niewystarczające, można rozważyć bardziej kompleksowe zmiany. Obejmują one wykorzystanie znaczników fuzyjnych, takich jak GST i białko wiążące maltozę (MBP), które zwiększają rozpuszczalność (Referencje: Esposito, D. i Chatterjee, D. K. Enhancement of soluble protein expression through the use of fusion tags. Current Opinion Biotech, 17, 353-358 (2006). Inne opcje obejmują koekspresję z chaperoninami lub innymi składnikami maszyn fałdujących oraz wykorzystanie alternatywnego organizmu gospodarza. Kompleksowy opis procedur zwiększających rozpuszczalną ekspresję wykracza poza zakres tego podręcznika.
Solubilizacja ciałek inkluzyjnych
Jeśli modyfikacje hodowli nie poprawiają znacząco wydajności ekspresji.znacząco poprawić wydajności rozpuszczalnych znakowanych białek, wówczas do solubilizacji ciał inkluzyjnych można użyć powszechnie stosowanych denaturantów, takich jak 4 do 6 M Gua-HCl, 4 do 8 M mocznik, detergenty, zasadowe pH (> 9), rozpuszczalniki organiczne lub N-laurylosarkozyna.
Powodzenie oczyszczania w obecności środków denaturujących będzie zależeć od natury znakowanego białka. Ważne jest, aby przetestować wybrany denaturant z docelowym białkiem przed wprowadzeniem go do strategii solubilizacji.
Dla każdego denaturantu na sukces solubilizacji będzie miała wpływ obecność i stężenie czynnika redukującego, czas, temperatura, siła jonowa i stosunek denaturantu do białka. Patrz Tabela 10.2 dla eksperymentalnych punktów wyjściowych dla solubilizacji ciał inkluzyjnych. Rozpuszczone białka mogą być często oczyszczone na tym etapie przy użyciu techniki separacji, która jest kompatybilna z obecnością denaturanta. Oczyszczanie i ponowne fałdowanie można często połączyć w tym samym etapie oczyszczania, na przykład poprzez chromatograficzne ponowne fałdowanie na kolumnie.
| Bufor | Denaturant | Stężenie w organizmie (mg/mL) | Temp. (mg/mL, mokra masa) | Temp (°C) | Czas | Środek redukujący | |
|---|---|---|---|---|---|---|---|
| Warunki początkowe | 50 mM Tris-HCl, pH 8.0 | 8 M mocznik | 10-20 | Otoczenie | 60 min | ||
| Zakres zmienności | (Niekrytyczne) | 6-8 M mocznika 6-8 M Gua-HCl | 4-95 | 15min- 12 h | 1-10 mM DTT lub TCEP (jeśli białko zawiera wiązania dwusiarczkowe) |
Opublikowano wiele alternatywnych protokołów solubilizacji (np. baza danych REFOLD). Opcje obejmują użycie SDS (10%), N-laurylosarkozyny lub innych detergentów i skrajnych pH.
Refolding rozpuszczonych rekombinowanych białek
Po solubilizacji, białka muszą być odpowiednio ponownie złożone, aby odzyskać swoją funkcję. Czynniki denaturujące muszą być zawsze usunięte, aby umożliwić ponowne złożenie białka i utworzenie prawidłowych połączeń wewnątrzcząsteczkowych. Krytyczne parametry podczas ponownego fałdowania obejmują pH, obecność odczynników redukujących (często stosuje się mieszaninę zredukowanych i utlenionych form słabego czynnika redukującego, np, Tabela 10.3 porównuje konwencjonalne metody ponownego składania z oczyszczaniem na kolumnie i ponownym składaniem.
Refolding zwykle wymaga szerokiej optymalizacji. Zawsze należy rozważyć inne alternatywy (jak wspomniano wcześniej), na przykład optymalizację parametrów ekspresji, stworzenie nowej konstrukcji lub zmianę hosta ekspresji.
| Techniki ponownego formowania | Zalety/Wady |
|---|---|
| Dializa | Trwa kilka dni. |
| Rozcieńczanie | Prosta technika. Może wymagać bardzo powolnego rozcieńczania przez dodawanie próbki kropla po kropli. Daje duże rozcieńczenie, często kilkusetkrotne. |
| SEC | Oddzielanie zagregowanego materiału od natywnego białka. Agregaty utworzone na kolumnie mogą być trudne do usunięcia. Często można stosować wysokie stężenia białka. Tylko małe objętości mogą być przetwarzane na kolumnę. Powolne. |
| Ponowne składanie na kolumnie | Szybkie i proste. Brak ograniczeń objętości próbki. Można stosować wysokie stężenia próbek. Ponownie złożony materiał można uzyskać w wysokim stężeniu po elucji. Sukces jest różny i zależy od białka. |
Refolding na kolumnie
Użycie białka znakowanego histydyną umożliwia zastosowanie prostej, ale skutecznej procedury oczyszczania i refoldingu na kolumnie, która wytwarza rozpuszczalne białko wykazujące pożądaną aktywność biologiczną. Protokół przedstawiony na Rysunku 10.1 został z powodzeniem zastosowany dla kilku różnych białek znakowanych histydyną.

Rysunek 10.1.Ogólny schemat ekstrakcji, solubilizacji i ponownego składania białek znakowanych (histydyną)6 wytwarzanych jako ciała inkluzyjne w komórkach E. coli.
Silne wiązanie białek znakowanych histydyną do unieruchomionych jonów metali dwuwartościowych nie jest zakłócane przez wysokie stężenia środków chaotropowych (takich jak mocznik lub Gua-HCl). W konsekwencji, białka znakowane (histydyną)6 mogą być rozpuszczane przez ekstrakcję chaotropową i wiązane z Ni Sepharose. Usunięcie zanieczyszczających białek i ponowne złożenie przez wymianę na bufor niedenaturujący można przeprowadzić przed elucją białka z kolumny.
Po ponownym sfałdowaniu białko może być dalej oczyszczane dowolną inną techniką chromatograficzną, tak jak w przypadku każdego natywnego białka (Rozdział 8, Purification of protein A-tagged proteins), jeśli wymagany jest wyższy stopień czystości.
Analiza prawidłowo sfałdowanych białek
Tabela 10.4 podsumowuje różne techniki stosowane do oceny, czy białka są prawidłowo sfałdowane.
| Właściwości białka | Techniki |
|---|---|
| Funkcja białka | Test aktywności enzymatycznej aktywność wiązania |
| rozmiar i masa cząsteczkowa | SEC SEC z MALLS (Multi-Angle Laser Light Scattering) Native PAGE MS |
| Mostki S-S | Chromatografia w odwróconej fazie MS |
| Struktura trzeciorzędowa | Wewnętrzna fluorescencja NMR |
| Struktura drugorzędowa | Dichroizm kołowy Zachowanie chromatograficzne (np.g., HIC, RPC lub IEX) |
| Zwartość stanu natywnego | Ograniczona proteoliza połączona z SDS-PAGE |
Zastosowanie
Purifikacja i ponowne formowanie na kolumnie nierozpuszczalnego białka znakowanego histydyną ze 100 ml hodowli E. coli przy użyciu kolumny HisTrap FF 1 mL z ÄKTAprime plus
Ta procedura wykorzystuje kolumnę HisTrap FF 1 mL, ale może być również stosowana z kolumną HisTrap HP 1 mL lub HisTrap FF crude 1 mL.
Przygotowanie buforów
Używaj wody i chemikaliów o wysokiej czystości, a przed użyciem przepuść wszystkie bufory przez filtr 0,45 µM.
| Bufor do zawiesiny: | 20 mM Tris-HCl, pH 8.0 |
| Bufor do izolacji: | 2 M mocznik, 20 mM Tris-HCl, 0,5 M NaCl, 2% Tween-20, pH 8.0 |
| Bufor wiążący (port A1): | 6 M Gua-HCl, 20 mM Tris-HCl, 0.5 M NaCl, 5 mM imidazol, 1 mM β-merkaptoetanol, pH 8.0 |
| Bufor rozpuszczający: | 6 M mocznik, 20 mM Tris-HCl, 0.5 M NaCl, (port A2) 5 mM imidazol, 1 mM β-merkaptoetanol, pH 8.0 |
| Bufor elucyjny (port A3): | 20 mM Tris-HCl, 0,5 M NaCl, 0,5 M imidazol, 1 mM β-merkaptoetanol, pH 8.0 |
| Bufor do ponownego formowania (port B): | 20 mM Tris-HCl, 0,5 M NaCl, 5 mM imidazol, 1 mM β-merkaptoetanol, pH 8.0 |
| Przygotuj co najmniej 500 ml każdego eluentu. | |
Alternatywne bufory wiążące: Do buforu wiążącego można dodać od 5 do 40 mM imidazolu w celu zmniejszenia niespecyficznego wiązania białek nieoznakowanych histydyną. Stężenie imidazolu zależy od białka, a jeśli interesujące białko eluuje lub nie wiąże się przy określonym stężeniu imidazolu, należy zmniejszyć stężenie.
Rozbijanie, płukanie i izolacja ciałek inkluzyjnych
- Zawiesić pastę komórkową ze 100 ml hodowli w 4 ml buforu do zawiesiny.
- Rozbić komórki za pomocą sonikacji na lodzie (np., 4 × 10 s).
- Wirować z dużą prędkością przez 10 minut w temperaturze 4°C.
- Usuń supernatant i ponownie zawieś osad w 3 ml zimnego buforu izolacyjnego. Sonikować jak wyżej.
- Wirować z dużą prędkością przez 10 minut w temperaturze 4°C.
- Powtórzyć kroki 4 i 5.
Na tym etapie materiał osadu można przemyć raz w buforze bez mocznika i przechowywać zamrożony do późniejszego przetworzenia.
Solubilizacja i przygotowanie próbki
- Zawiesić osad w 5 ml buforu wiążącego.
- Wstrząsać przez 30 do 60 minut w temperaturze pokojowej.
- Wirować przez 15 minut z dużą prędkością, 4 °C.
- Usuń wszelkie pozostałe cząstki przepuszczając próbkę przez 0.45 µM.
Optymalne stężenie β-merkaptoetanolu (od 0 do 20 mM) należy określić eksperymentalnie dla każdego białka.
Jeśli próbka nie została przygotowana w powyższy sposób, należy dostosować ją do składu buforu wiążącego poprzez rozcieńczenie w buforze wiążącym lub wymianę buforu przy użyciu kolumny odsalającej (Rozdział 11, Desalting/Buffer Exchange and Concentration), a następnie przepuścić próbkę przez 0.45 µM.
Przygotowanie systemu
Jeśli wybrano liniowe tworzenie gradientu do ponownego formowania i elucji, użycie systemu chromatograficznego jest niezbędne.
W tym przykładzie użyto ÄKTAprime plus. Po przygotowaniu systemu pozostałe kroki (w sekcji Wybór szablonu aplikacji i uruchomienie metody) zostaną wykonane automatycznie.
- Umieść każdą rurkę wlotową z portu A (zawór 8-portowy) w eluentach, jak podano powyżej, a rurkę z portu B (zawór 2-portowy) w buforze elucyjnym.
- Umieść trzy brązowe rurki odpadowe w odpadach.
- Podłącz kolumnę między portem 1 na zaworze wtryskowym (zawór 7-portowy) a komorą przepływową UV.
- Napełnij stojak kolektora frakcji probówkami 18 mm (minimum 40) i umieść białą płytkę na ramieniu frakcjonującym względem pierwszej probówki.
- Podłącz pętlę próbki wystarczająco dużą dla próbki między portami 2 i 6 na zaworze wtryskowym. Użyj strzykawki do ręcznego napełnienia pętli.
Uwaga: Jeśli potrzebna jest pętla Superloop™, dodatkowe informacje znajdują się w instrukcji dla pętli Superloop.
Wybór szablonu aplikacji i uruchomienie metody
- Sprawdź komunikację z PrimeView. W prawym dolnym rogu ekranu powinien zostać wyświetlony tekst Controlled By: prime.
- Użyj przycisków strzałek i OK, aby poruszać się po drzewie menu, aż znajdziesz On-Column Refolding HisTrap.

3. Wprowadź objętość próbki i naciśnij OK, aby uruchomić szablon.

Rysunek 10.2.Teoretyczny gradient w szablonie aplikacji On-column Refolding HisTrap

Rysunek 10.3.Ponowne formowanie na kolumnie białka znakowanego histydyną.
Warunki przesiewowe dla ponownego fałdowania przy użyciu IMAC
Płytki 96-dołkowe MultiTrap są użytecznymi produktami do badań przesiewowych warunków ponownego fałdowania IMAC (Tabela 10.5). W tym przykładzie, rozpuszczone, niesfałdowane białko zostało dozowane do studzienek His MultiTrap FF. Białka inkubowano w różnych buforach do ponownego fałdowania i określano stopień ponownego fałdowania (Rys. 10.4). Optymalne bufory z podobnych eksperymentów przesiewowych mogą być wykorzystane do zwiększenia skali refoldingu w kolumnie na HisTrap FF.
| Produkt | Opis |
|---|---|
| His MultiTrap™ FF | Płytka 96-dołkowa; 800 µL studzienek wypełnionych 50 µL Ni Sepharose®.6 Fast Flow |
| His MultiTrap™ HP | Płytka 96-dołkowa; 800 µL studzienek wypełnionych 50 µL Ni Sepharose®.wypełnione 50 µL Ni Sepharose® High Performance |
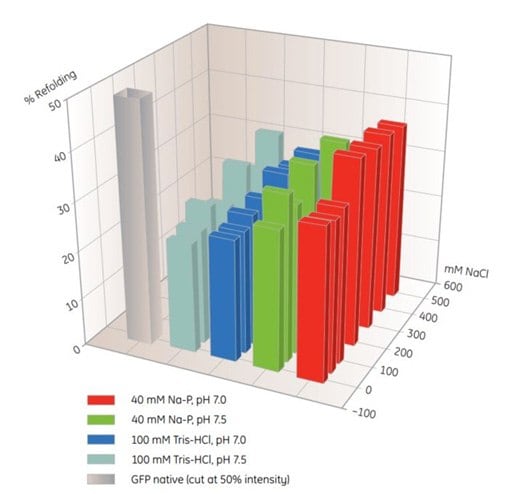
Rysunek. 10.4.Badanie warunków ponownego składania IMAC dla GFP znakowanego histydyną przy użyciu His MultiTrap™ FF. Wstępne badania obejmowały substancje buforowe, pH i stężenia soli. Dane uprzejmie dostarczone przez J. Buchner, M. Haslbeck i T. Dashivets, Uniwersytet Techniczny w Monachium, Niemcy.
Network error: Failed to fetch
Network error: Failed to fetch
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?Dla wygody naszych klientów ta strona została przetłumaczona maszynowo. Dołożyliśmy starań, aby zapewnić dokładne tłumaczenie maszynowe. Tłumaczenie maszynowe nie jest jednak doskonałe. Jeśli tłumaczenie maszynowe nie spełnia Twoich oczekiwań, przejdź do wersji w języku angielskim.