Micro Review:RAFT重合
Graeme Moad, Ezio Rizzardo, San H. Thang
CSIRO Molecular and Health Technologies, Clayton, Victoria, Australia
はじめに
RAFT(可逆的付加-開裂連鎖移動:Reversible Addition Fragmentation chain Transfer)重合とは可逆的不活性化ラジカル重合(RDRP:Reversible Deactivation Radical Polymerization)であり、ラジカル重合にリビング性を与えることのできる、より汎用的な方法の一つです1-7。CSIRO(豪州連邦科学産業研究機構:The Commonwealth Scientific and Industrial Research Organisation)においてこれまで行われたRAFT重合の開発については、既報にてまとめてあります1。RAFT重合の利点を以下に挙げます。
- ラジカル重合で重合可能な大部分のモノマーの重合反応を制御できること。適用可能なモノマーには、(メタ)アクリラートや(メタ)アクリルアミド、アクリロニトリル、スチレン、ジエン、その他様々なビニル化合物が挙げられます。
- モノマーや溶媒中の保護されていない官能基(例えば、OH、NR2、COOH、CONR2、SO3H)に対する許容性の高さ。水またはプロトン性溶媒中で重合可能です。
- 反応条件の適用範囲が広いこと(例えば、バルク量の合成、有機溶媒または水溶液、エマルション、ミニエマルション、懸濁液)。
- 競合する技術と比較して、利用しやすく安価であること。
理想的なリビング重合では、反応初期に全てのポリマー鎖において重合反応が開始し、同じ反応速度で成長し、重合が続いていきます。すなわち、不可逆的連鎖移動や停止反応が存在しません。開始反応が成長反応と比較して速い場合には分子量分布は非常に狭くなり、また、反応系にさらにモノマーを追加することでポリマー鎖を伸ばすことができます。ラジカル重合では、ポリマー鎖の全てが同時に活性化することはありません。RAFT重合のようなRDRPにおいて、リビング性が現れるのは、リビング鎖の大部分がドーマント型(休止型)であるように、成長するラジカル種を可逆的に不活性化できる化合物が存在し、活性鎖とドーマント鎖との間に速い平衡が存在するためです(図1)。

図1RAFT重合の概略図4。ここに示した各タイプのポリマー鎖の数は、理想的な実験で期待される数には比例していません。平均すると、すべてのリビング鎖が同時に成長し、等しい鎖の長さになりますが、これはドーマント鎖末端と活性鎖末端との間の平衡が、成長反応に対して十分に速いためです。RAFT剤は「ZC(=S)S」で示しました。
このような反応条件下では、モノマーの転化が進むにつれて分子量は直線的に増加し、分子量分布を非常に狭くすることができます(図2)。そして重合生成物の大部分は、ドーマント鎖から構成されます。

図2同等の反応条件における、スチレンの従来の重合法とRAFT重合の典型的な分子量分布4。
RAFT重合における成長末端の活性化/不活性化のメカニズムをスキーム1に示しました。一般的なラジカル重合の素反応(開始反応、成長反応、停止反応)の他に、RAFT平衡に関連する反応が加わるのがポイントです。理想的なRAFT重合では、RAFT剤が連鎖移動剤として機能します。停止反応が、RAFT反応によって抑制されるわけではありません。RAFT重合はリビング特性を示す反応であるため、重合生成物中にチオカルボニルチオ基が残存し、ブロック共重合体や末端官能性ポリマーの合成に適した反応であるといえます。一方、着色などのために一部の応用にはチオカルボニルチオ基の除去や変換が必要となることがあります。これまでに末端基除去のための方法が多数報告されており、ポリマー合成に容易に取り入れることが可能です10,12-16。

スキーム1可逆的付加-開裂連鎖移動(RAFT)のメカニズム
用いるモノマーと反応条件に適したRAFT剤(ZC(=S)SR)の選択が、RAFT重合を成功させるためには不可欠です。ただしその選択は難しいものではありません。RAFT剤の有効性は置換基RとZとにより決定され、その選択基準はすでに示されています(図3)1,3。わずか2群のRAFT剤のうち1群を用いることで大部分のモノマーの重合は十分に制御可能であり、重合の遅延を最小限にしながらも、高いリビング鎖の比率を達成できます。一方のRAFT剤群は高活性なモノマー(MAM:more activated monomer)、例えばメタクリル酸メチル(MMA、M55909)、メタクリル酸(MAA、155721)、ヒドロキシプロピルメタクリルアミド(HPMAM)といったメタクリル系、アクリル酸メチル(MA、M27301)、アクリル酸(147230)、アクリルアミド(AM、A8887)、アクリロニトリル(AN、320137)といったアクリル系、スチレン(St、28-5435)などに適しています。もう一方のRAFT剤群は低反応性モノマー(LAM:less activated monomer)、例えば、酢酸ビニル(VAc、V1503)、N-ビニルピロリドン(NVP)、またはN-ビニルカルバゾール(NVC)などに適しています。
最近、MAMとLAMの両方の重合を制御できる、切り替え可能なRAFT剤が報告されました8,9。特別な末端官能性やポリマー構造が必要な場合は、他のRAFT剤を使用することがあります10,11。

図3様々な重合に適したRAFT剤(Z-C(=S)S-R)の選択基準1,3。「Z」については左から右に向けて付加速度と移動定数が減少し、開裂速度は増加します。「R」については左から右に向けて、開裂速度が減少します。点線は制御が難しいこと(例えば、重合遅延や高分散度など)を示しています。
化合物と重合条件を適切に選択することで、RAFT重合は十分に制御されたホモポリマーやグラジエントポリマー、ジブロックポリマー、トリブロックポリマー、星型ポリマーのほかに、マイクロゲルやポリマーブラシなどのより複雑な構造の高分子合成にも利用可能です。現在報告されている応用例は、新規な界面活性剤や分散剤、塗料、接着剤から、生体材料や膜、ドラッグデリバリー媒体、電場応答性(電気活性)材料、そしてナノテクノロジー関連の分野にまで渡っています。
「高活性なモノマー」(MAM)のRAFT重合
トリチオカルボナート(Z = S-アルキル、例えば4~6)を用いることで、MAMの重合反応において優れた制御が達成できています。この場合、Zは低揮発性なチオール系の構造であることが望まれます。芳香族ジチオエステル(Z = アリール、例えば9、10)はRAFT剤の中でも最も高活性なものであり、MAMの重合で一般的に用いられている化合物です1,2。しかし芳香族置換RAFT剤は、高濃度で使用した場合に重合を非常に遅くしてしまうことがあり、また加水分解やルイス酸による分解に対してより敏感です17,18。加水分解が懸念される場合には、アルキル置換RAFT剤(4~6)を用いてもよいでしょう。ビス(チオカルボニル)ジスルフィド7と8は、三級RAFT剤の前駆体として有用で、重合時にin situでRAFT剤を生成するためにも用いられます19。
Rは、重合を効果的に再開し、成長ラジカルに対して良好なホモリシス型脱離基でなくてはなりません20。また、R• も重合再開において効果的、すなわち成長速度の点で迅速にモノマーに付加しなくてはなりません。例えばアクリラートやアクリルアミドの場合、R = シアノメチルであるRAFT剤6が適しています。メタクリラートの場合、「R」の選択は非常に重要です。RAFT反応の有用性を、以下のメタクリル酸メチル(MMA)のRAFT重合例で説明します。高転化率(80-100%)のMMA重合を90℃で、1,1’-azobis(1-cyclohexanecarbonitrile)開始剤を用いて行い、またS-dodecyl S-(2-cyano-4-carboxy)but-2-yl trithiocarbonate 5を約60倍の濃度範囲で用いました10。6時間後に測定した分子量分布を図5に示します。得られた分子量は2,600から125,000の範囲で、これはRAFT剤の濃度と使用した開始剤の濃度に基づいた予測とよく一致しています10。また、全てのサンプルで狭い分子量分布を示しています(PDI< 1.2)。
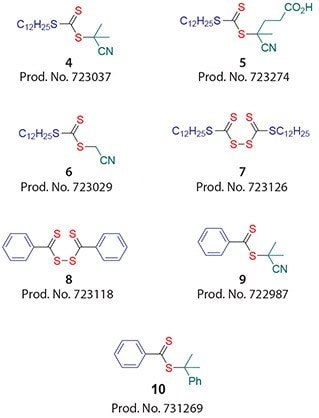
図4MAMに対して良好な重合制御特性を示す一連のRAFT剤

図5MMA(6.55 Mベンゼン溶液)の高転化率RAFT重合により生成したPMMAの分子量分布。1,1’-azobis(1-cyclohexanecarbonitrile)(0.0018 M)を開始剤に用い、様々な濃度のRAFT剤5を用いて、90℃で6時間反応させました10。
「低反応性モノマー」(LAM)のRAFT重合
低活性RAFT剤(Z = NR’2(ジチオカルバマート)、Z=OR’(キサンタート、ザンテート)、R’=アルキルまたはアリール)を用いた場合も良好な重合反応の制御が可能です。高活性RAFT剤(Z = R(ジチオエステル)またはSR(トリチオカルボナート))では、LAMの重合を阻害してしまいます。この種類のモノマーの大部分は高い成長速度定数を持つため、R基の選択もまた非常に重要となります。12や13などのRAFT剤では再開始反応が遅いので、重合に誘導期が存在することが多々あります。推奨するRAFT剤に11があり、このRAFT剤を用いたVAcの重合の例を表1に示します7。

図6LAMに対して良好な重合制御を示す一連のRAFT剤
切り替え可能なRAFT剤
我々は最近、刺激応答性の新規RAFT剤について報告しましたが、これはMAMとLAMの両方の重合で良好な制御を達成できる「切り替え可能な」RAFT剤であり、より狭い分子量分布を持つpolyMAM-block-polyLAMポリマーのより簡便な合成が可能になりました9。たとえば、この4-pyridinyl-N-methyldithiocarbamate誘導体を用いた手法による、PMMA-block-PVAcおよびPMA-block-PNVCの合成が行われています。この誘導体によってN-4-pyridinyl-N-methyldithiocarbamatesは、LAMの重合を効果的に制御でき(スキーム2)、プロトン化された場合は、MAMの重合を効果的に制御できます9。
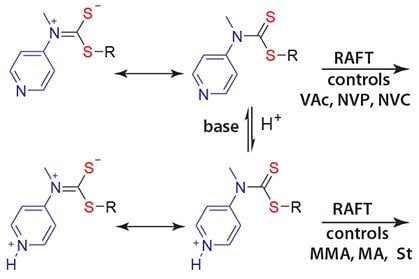
スキーム2pHを制御することで、LAMとMAMの両方の重合が可能なRAFT剤
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?