DDS向け生分解性ポリマー薬物担体:機能性脂肪族ポリエステルの設計
Vasanthy Karmegam1, Pooneh Soltantabar2, Erika Joy L. Calubaquib1, Ruvanthi N. Kularatne1, Mihaela C. Stefan1,2
1Department of Chemistry and Biochemistry, University of Texas at Dallas, Richardson, TX 75080, 2Department of Bioengineering, University of Texas at Dallas, Richardson, TX 75080
Material Matters, 2017, 12.2
Material Matters PDF版
はじめに
ポリマーの技術革新は、新しいドラッグデリバリーシステム(薬物送達システム、DDS)の発展に大きな影響を与えています。ほとんどのポリマー系ドラッグデリバリーシステムは、投薬の頻度を減らすため、大用量(large dose)の治療薬を制御して標的部位へ送達するように設計されています。しかし、ポリマー系薬物担体が体内に蓄積すると著しい健康リスクとなる場合があり、多くのポリマー系ドラッグデリバリーシステムの重大な欠点となっています。例えば、ポリスチレン(PS)、ポリメチルメタクリラート(PMMA)、ポリ(N-イソプロピルアクリルアミド)(PNIPAM)は生分解性が低いため、ドラッグデリバリー用途への応用の可能性は限定されています1。
対照的に、脂肪族ポリエステルは生分解性や生体適合性に優れていることから、最近数十年間にわたってドラッグデリバリーシステムとして大きな注目を集めるようになっています。ポリエステル骨格はin vivoで分解するため、担体材料や分解生成物が体内に蓄積せず、長期的な毒性のリスクが軽減されます2。ドラッグデリバリー用途で一般的に使用されているポリエステル類は、ポリラクチド(PLA)、ポリカプロラクトン(PCL)、ポリグリコリド(PGA)、ポリジオキサノン(PDO)、ポリブチロラクトン(PBL)、ポリバレロラクトン(PVL)、ポリ(ラクチド-co-グリコリド)(PLGA)などです(図1)3。

図1ドラッグデリバリー用途で一般的に使用されているポリエステル類
現在のがん治療研究の重要な焦点は、腫瘍部位への抗がん剤の標的化した送達と、搭載された治療薬の能動的な放出とを組み合わせて行うことです。刺激応答性のポリマー系薬物担体では、がん組織と健全な組織の間の生理学的環境の差異を利用して腫瘍部位で薬物を放出するために、通常、ナノ担体(ミセル系、ナノ粒子、ポリマーソーム、デンドリマーなど)を用います。薬物担体の部位特異性をさらに向上させるためには、薬物担体を標的化部分とコンジュゲーションすることで、特定の腫瘍部位へ送達できるようにすることが可能です。本稿では、がん治療に向けた脂肪族ポリエステル類の開発における最近の進展に重点を置き、特にポリエステルの合成、刺激応答性薬物担体、能動的標的化を中心に紹介します。
ポリエステルの合成
脂肪族ポリエステル類の合成法として、二酸とジオールの重縮合や、環状エステル類の開環重合(ROP:ring-opening polymerization)などの複数の方法があります。重縮合には、反応物質間の正確な化学量論、副生成物(水など)の連続的な除去、高温、および長い反応時間が要求される、さらには高分子量のポリマーを得ることが困難であるという欠点があります4。これに対して開環重合では、通常、高分子量のポリエステル類が得られ、副反応も限定的です。開環重合は容易で、多様な開始剤および触媒を利用できることから、環状エステルモノマーの重合に広く使用されています。環状エステルの開環重合に使用される最も一般的な機構は、配位‐挿入、酵素、アニオンの3種です4。
配位‐挿入開環重合は、アルコールまたはアミンによって開始され、スズ、アルミニウム、亜鉛のようなルイス酸性の金属に基づく金属錯体が触媒となります1。この方法では高分子量のポリマーが得られますが、最終的なポリマーに残留する微量の金属触媒が、生物学的用途を制限する重要な欠点となります。例えば、ビス(2-エチルヘキサン酸)スズ(II)はポリエステルの合成に一般的に使用されるFDA承認済みの食品添加物ですが、スズの毒性のため、食品または生物医学用途に使用する場合は残留濃度が一定のしきい値よりも低くなければなりません4。
酵素開環重合は一般に温和な条件でリパーゼを触媒に使用し、毒性のある金属は使用されません。この方法では、立体選択性、化学選択性、位置選択性のあるポリエステル類5を作製することができますが、一般に得られるポリエステル類の収率は比較的低く、多分散度が高くなります3。アニオン開環重合では、高分子量のポリエステル類が得られますが、バックバイティングによる副反応が頻繁に起こります4。
ポリエステル薬物担体および薬物の放出
適切なポリマー担体を選択し、その性質をうまく調節することで、薬物送達における薬物の担持効率の向上、薬物の投与量および投薬頻度の低減、副作用の緩和、患者適合性の向上、in vivo半減期の短縮を確実に実現することができます。合成ポリマー由来の薬物担体として最も広く研究されているのは、両親媒性ブロックコポリマーの自己組織化で形成されるミセル、ナノ粒子、ポリマーソームです。ナノ粒子の形成は、温度、pH、電解質、溶媒を変えることで速度論的に制御可能で、通常のサイズは10~1000 nmの範囲です3,7。ミセルの形成は熱力学的に支配されており6、臨界ミセル濃度(CMC:critical micelle concentration)以上でユニマー(単一のポリマー鎖)が会合するときにのみ進行して、サイズが5~100 nmの範囲の粒子が形成されます3,7。疎水性セグメントとの相互作用により薬物がミセルのコアに移動して、コア‐シェル型のマトリックスを形成します。これに対してポリマーソームは、水溶液で満たされたコアと、これを取り巻く形で球の内側と外側の双方に位置する親水性コロナで構成される二重層膜からなります。この特異な構造により、ポリマーソームは疎水性の薬物と親水性の薬物の双方をカプセル化することができます。
ポリマー系薬物担体は、搭載した薬物を大量に作用部位へ送達するとともに、侵食または刺激を引き金とする放出によって、生理学的条件下で制御された持続的な薬物放出を可能にします2,3,8。水が浸透すると、ポリエステルは加水分解されて、ポリマーの大部分が失われます。ポリマー骨格の特性に応じて、侵食はナノ担体のバルクまたは表面のいずれでも起こり得ます(図2)。表面侵食は、ポリマー全体への水の浸透速度よりも分解速度が速いときに起こります。一方、バルク侵食は、ポリマー全体への水の浸透速度のほうが侵食速度よりも速いときに起こります。生分解性ポリエステル類の大多数は、含有される脂肪族の割合が高いため、バルク侵食によって分解します。最近、薬物放出を制御するため、表面とバルクの両方の機構で侵食できるように表面積を拡大したポリマー系薬物担体が使用されてきています2,5,8。
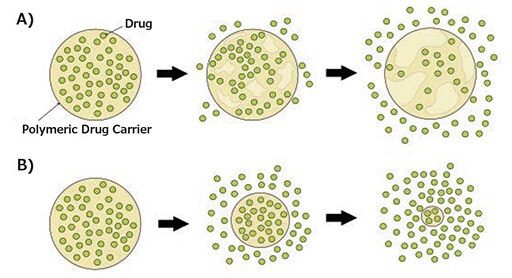
図2生分解性ポリマー系薬物担体の分解機構。A)バルク侵食、B)表面侵食。
カプセル化した薬物が早期に放出されるのを防ぐため、pH、温度、還元、酵素、光などの外部の刺激を受けたときだけ充填されている薬物を放出するように設計された担体もあります(図3)3。これにより、薬物の治療有効性が向上し、健全な細胞に対する潜在的な毒性が軽減されます9。
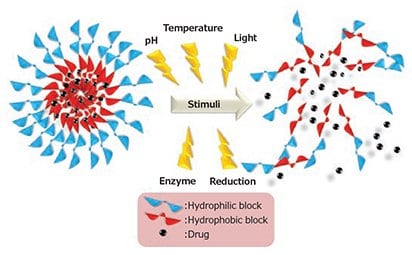
図3刺激応答性薬物放出の概略図
刺激応答性ポリエステル薬物担体
ポリマー系薬物担体は、EPR効果(enhanced permeability and retention effect)に基づく受動的な標的化によって腫瘍部位に進入することができます。この現象の結果、腫瘍部位に存在する漏出性の血管系を介して、サイズが10~100 nmの範囲のナノ粒子が蓄積します3。この効果を利用することに加えて、正常な組織と腫瘍組織の間の生理学的環境の差異に基づいて単一または複数の刺激に応答するようにポリマー系薬物担体を設計することができます。健全な組織とがん組織の間の酸性度の差異を利用して、pHに依存した放出機構が開発されています。
例えば、健全な組織のpHは7.4ですが、腫瘍組織の細胞外環境のpHは6.8、細胞内のエンドソーム/リソソームのpHは4.0~6.5の範囲です10。酸に不安定な官能基が存在すると、薬物担体は酸性環境で開裂し、腫瘍部位で薬物を放出します。pH応答性(mPEG-PLA)‐クルクミンプロドラッグの合成とその後の自己組織化によるミセル系の形成についてZhaoらが研究しています11。この薬物はpH応答性のアセタール結合を介してポリマーにコンジュゲーションしており、48時間後にpH 5では45%超のクルクミンがミセル系から放出されるのに対して、pH 7.4では20%未満の放出にとどまります11。
また、健全な細胞とがん細胞の間のグルタチオン(GSH)濃度の差異も刺激として利用できます。腫瘍細胞の細胞内GSH濃度は2~10 mM程度であり、健全な細胞のGSH濃度よりも数倍高くなっています10。GSH濃度が増加すると還元応答性のジスルフィド結合が開裂するため、担持物質を腫瘍部位に放出することができます12。ジスルフィド結合を含んだPEG-PLA両親媒性ブロックコポリマーを使用した還元応答性ミセル系ドラッグデリバリーシステムが、Shenらによって開発されています。還元環境では、ジスルフィド結合の開裂によりドキソルビシン(DOX)が迅速に放出されました。還元剤のジチオスレイトール(DTT)の存在下で、14時間後に最大64%のDOXがPEG2000-PLA5000ミセルから放出されました。DTTがない場合、14時間後に放出されたDOXは40%にとどまりました12。
熱応答性ドラッグデリバリーシステムは、通常、下限臨界溶解温度(LCST:lower critical solution temperature)ないしは上限臨界溶解温度(UCST:upper critical solution temperature)を持つポリマーからなります。LCST以上の温度でポリマーは相転移を起こし、水に不溶になります13。通常は、LCSTが正常な生理学的温度(37℃)よりも高いポリマーが熱応答性DDSに使用されます。これらのポリマーは体内で内包した薬剤を保持することができ、熱を加えると相転移して腫瘍組織で薬物のバースト放出を起こします。熱応答性モノマーであるγ-2-[2-(2-メトキシエトキシ)エトキシ]エトキシ-ε-カプロラクトン(MEEECL)がStefanらによって導入され、オクチルオキシ-ε-カプロラクトン(OCTCL)と組み合わせてLCSTが38℃の両親媒性ブロックコポリマーが作製されました14。OCTCLをγ-(2-メトキシエトキシ)-ε-カプロラクトン(MECL)と入れ替えることで、LCSTを31~43℃の範囲で調節することができました。温度がコポリマーのLCSTを超えると、得られるミセルのサイズが約150 nmから400 nmに増加しました13。さらに、カプロラクトンモノマーのγ位の置換基を変えると、親水性ブロックとしてMEEECLを使用した一連の自己組織化ミセル系の熱応答性挙動に影響することが、実験と計算の双方で示されました(図4)。得られた両親媒性ジブロックコポリマーのLCSTは36~39℃の範囲にあることが判明しました15。

図4ドラッグデリバリー用途に向けた単一刺激応答性ポリエステル類。応答性単位に色付け(pH=赤、温度=緑、還元=青)しています。
単一の刺激に応答するポリマー系ドラッグデリバリーシステムは薬物送達技術の発展に著しい影響を与えていますが、最近の取組みでは2つ以上の刺激に応答するシステムに焦点を合わせています。pHおよび酸化還元に対する二重応答性システムがGeら16によって報告されており、このシステムではコポリマープロドラッグがPEG-b-PCLミセルにカプセル化されています。コポリマープロドラッグは、pH応答性のメタクリル酸2-(ピペリジン-1-イル)エチル(PEMA)と還元応答性のカンプトテシン(CPT)の重合によって調製されました。polyPEMAは酸性pHでプロトン化するため、ミセルのゼータ電位が-2 mVから+12 mVに増加し、その結果、ミセルのサイズが32.7 nmから48.6 nmに増加しました。GSH濃度の増加に応答して、ジスルフィド結合の開裂により80%のCPTが放出されました。Chenらが設計した熱およびpH応答性ミセルは、疎水性のPCLセグメントと親水性の熱応答性ポリ(N-イソプロピルアクリルアミド)(PNIPAM)セグメントからなり、このPNIPAMセグメントはpH応答性のβ-アラニン修飾モノマー(βA)との共重合により構築されています17。このミセルにDOXと光増感剤のmeso-テトラフェニルクロリンの両方が充填されました。このポリマーのLCSTはpH 7.4では37℃ですがpH 6.0では25.8℃に降下するため、カプセル化した薬物が酸性環境で放出されます。その結果、酸性環境では70%、中性環境では40%のDOXが放出されました。
Zhaoらは、還元応答性のジスルフィド結合をもち、PEG、PCL、およびpH応答性のアセタール結合を介して熱応答性PNIPAM骨格がグラフトされた、複数応答性の櫛形コポリマーを設計しました(図5)10。この二重に切断可能で複数応答性を持つグラフト共重合体の凝集物は、刺激を加えた後に大量のDOXを放出することが示されました。中性pH、酸性pH、温度上昇、DTTの存在下または非存在下など、異なる環境で累積的なDOXの放出が研究されました。37℃、pH 5.3、DTTの存在下で最大の放出となる77.1%が観測された一方、25℃、pH 7.4、DTTの非存在下での放出は36.1%にとどまりました。刺激応答性担体は標的とする部位に蓄積する確率が増加しますが、能動的標的化を使用してドラッグデリバリーシステムを体内の特定部位に向かわせることもできます。

図5ドラッグデリバリー用途に向けた複数刺激応答性ポリエステル類。応答性単位に色付け(pH=赤、温度=緑、還元=青)しています。
能動的標的化ポリエステル薬物担体
受動的な標的化と比較して、能動的な標的化をした薬物送達ではカプセル化した薬物の標的部位への送達が可能になり、正常な細胞への毒性リスクが軽減され、腫瘍細胞を排除するために十分な濃度に薬物が蓄積することを可能にします。受動的標的化と能動的標的化の比較を図6に示します。通常、標的化部分は、ポリマー末端基の変換ないしはポリマー骨格中へのコンジュゲーションによってポリマーに接続されます。抗体、タンパク質、ペプチド、炭水化物、ビタミン、核酸などの多様な種類の標的化部位を使用することができます3。

図6受動的標的化と能動的標的化を示した模式的な図
Zhongらは、ジスルフィド結合を含む生分解性ポリマー系マトリックス(PEG-SS-PCL)を環状アルギニン-グリシン-アスパラギン酸(cRGD)ペプチドで修飾することで、αvβ3インテグリンに対する高い親和性をもつcRGD/PEG-SS-PCLナノミセルを調整しました。αvβ3インテグリンは、U87MG神経膠腫細胞やB16黒色腫細胞などの脈管原性腫瘍内皮細胞および悪性腫瘍細胞で過剰発現する重要なバイオマーカーです。これらのDOXを担持した修飾ナノミセルの50%阻害濃度(IC50)は6.36 µg/mLで、修飾されていないミセル(IC50 = 18.35 µg/mL)の2.9分の1に低下しました。in vivoの生体内分布の研究がU87MG担腫瘍ヌードマウスを使用して行われました。注射後4時間のex vivoのDOX蛍光イメージングでは、cRGD/PEG-SS-PCLで送達されたDOXの蓄積が、肝臓、心臓、脾臓、肺、腎臓組織と比較して、腫瘍で高濃度になっている(4.38% ID/g)ことが明らかにされました。さらに、この濃度はPEG-SS-PCLで送達されたDOXの濃度(1.99% ID/g)よりも2.2倍高くなっていました18。
Zhouらは、酸化還元応答性プロドラッグ、mPEG-SS-CPTとフェニルボロン酸(PBA)で修飾した酵素応答性コポリマー、およびPBA-PEG-4,4’-(ジアゼン-1,2-ジイル)ベンゾイル-PCL(PBA-PEG-Azo-PCL)の自己組織化から作製された二重応答性ポリマーミセルについて報告しています。PBAは肝細胞がん細胞で過剰発現するシアル酸と相互作用するため、PBAで修飾した担体ではin vitroでのHepG2細胞への取り込みが増加します。さらに、H22担腫瘍ヌードマウスでは注射後6時間で腫瘍部位に強い蛍光が残り、標的化していないミセルを用いた場合と比較して1.84倍の強度でした19。
最後に、酸に不安定なヒドラゾン結合でDOXとコンジュゲーションされたポリ(メタクリル酸ポリ(エチレングリコール))‐ポリ(カプロラクトン)‐ポリ(メタクリル酸ポリ(エチレングリコール))(pPEGMA-PCL-pPEGMA)トリブロックコポリマーについて述べます。このpH応答性システムは、葉酸および/またはAS1411アプタマーでさらに修飾されました。葉酸およびAS1411アプタマーは、がん細胞で過剰発現する葉酸およびヌクレオリン受容体にそれぞれ特異的に結合します。蛍光活性化細胞選別法を使用して、MCF-7およびPANC-1細胞においてこの二重標的化システムの細胞取り込みが、単一標的化および非標的化ナノ粒子と比較して、それぞれ10倍および100倍増加することが示されました。さらに、非がん細胞株L929はDOXによる有害な影響を示しませんでした20。
結論
生分解性脂肪族ポリエステルは多用途性に優れているため、広い範囲の抗がん剤の送達用途で優れた候補となることが示されています。ポリエステル系薬物担体が備える刺激応答性および抗がん剤の標的化した放出は、健全な細胞に対する有害な副作用を抑えながら治療有効性を向上しています。脂肪族ポリエステル類は構造および機能の多様性に優れており、次世代ドラッグデリバリーシステムの開発に劇的な影響を与えるような優れた機能を持つ新規材料を作製する新たな機会をもたらします。抗がん剤の送達用途に向けた脂肪族ポリエステル類の開発が進展することで、実験室から臨床試験への移行が今後も続き、がん治療における治療選択と患者のアウトカムの双方が改善されるでしょう。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?