A rekombináns fehérjeexpresszió során keletkező zárványtestek kezelése
A rekombináns fehérjéket leggyakrabban az intracelluláris térben fejezik ki, de az expresszió úgy is szabályozható, hogy a fehérje a periplazmatikus térbe vagy a táptalajba szekretálódik. Bár a szekréció előnyös a fehérje hajtogatása, oldhatósága és disulfide kötése szempontjából, az intracelluláris expresszió alkalmazásakor a hozam általában sokkal nagyobb.
Az intracellulárisan felhalmozott rekombináns fehérje azonban gyakran zárványtestek, a biológiai aktivitással nem rendelkező, rosszul hajtogatott fehérje oldhatatlan aggregátumai formájában rakódik le. A rekombináns fehérje gyakran a zárványtestek fő összetevője. A zárványtestek előállítása ezért jelentős jelentőségű tisztítási lépés lehet. A fehérjék izolálása a zárványtestekből azonban gyakran nehézségekhez vezet az újraformázás során, és általában nem biztosítja a biológiai aktivitás teljes visszanyerését. A 10.1. táblázat összefoglalja a rekombináns termékekkel való munka előnyeit és hátrányait, amelyeket inklúziós testek formájában fejeznek ki. A zárványtestek képződése gyakran fordul elő, amikor eukarióta fehérjéket fejeznek ki bakteriális gazdaszervezetben.
Ha a fehérje zárványtestek formájában fejeződik ki, több lehetőséget kell mérlegelni: a lehető legnagyobb mértékben optimalizálni az oldható expressziót, elfogadni a zárványtestek kialakulását, de stratégiákat kidolgozni a fehérje szolubilizálására és újraformázására, más expressziós gazdaszervezetet kipróbálni, vagy módosítani a plazmidkonstrukciót. A zárványtestek formájában történő expresszió lehetővé teheti a gazdasejtre toxikus fehérjék expresszióját.
Optimalizálás az oldható expresszióra
A zárványtestek kialakulásának okai nem jól ismertek. Az azonban jól ismert, hogy a csökkentett növekedési sebesség általában több szolubilis expressziót eredményez, és így csökkenti a zárványtestek kialakulásának tendenciáját.
A tenyésztési körülmények néhány egyszerű, a növekedési sebesség és/vagy az expresszió sebességének csökkentését célzó módosítását érdemes megfontolni az oldható expresszió optimalizálása érdekében. Hátránya, hogy ennek következtében valószínűleg a rekombináns fehérje összhozama is csökken.
A növekedési sebesség csökkentése a növekedési hőmérséklet 20 °C és 30 °C közé csökkentésével érhető el.
Az indukálható promóter kontrollja alatt kifejezett fehérjék esetében az indukciós feltételek megváltoztatásával szintén csökkenthető a kifejeződési sebesség:
- indukálható alacsonyabb sejtsűrűségnél (A600 = 0.5)
- rövidebb ideig indukáljuk
- az indukálószer alacsonyabb koncentrációjával indukáljuk (pl, 0,1 mM IPTG)
Ha ezek a módosítások nem bizonyulnak elégségesnek, átfogóbb változtatások is megfontolhatók. Ezek közé tartozik a fúziós címkék, például a GST és a maltózkötő fehérje (MBP) használata, amelyekről beszámoltak, hogy javítják az oldhatóságot (Hivatkozás: Esposito, D. és Chatterjee, D. K. Enhancement of soluble protein expression through the use of fusion tags. Current Opinion Biotech, 17, 353-358 (2006). További lehetőségek közé tartozik a chaperoninnal vagy más hajtogatógépészeti komponensekkel való koexpresszió, valamint egy alternatív gazdaszervezet használata. Az oldható expressziót növelő eljárások átfogó leírása nem tartozik e kézikönyv tárgykörébe.
Az inklúziós testek szolubilizálása
Ha a tenyésztési módosítások nem szignifikánsak.nem javítják jelentősen az oldható jelölt fehérjék hozamát, akkor a zárványtestek szolubilizálására olyan gyakori denaturálószerek használhatók, mint a 4-6 M Gua-HCl, a 4-8 M karbamid, detergensek, lúgos pH (> 9), szerves oldószerek vagy N-laurilszarkozin.
Az affinity purifikáció sikere denaturáló szerek jelenlétében a jelölt fehérje természetétől függ. Fontos, hogy a választott denaturálószert a célfehérjével teszteljük, mielőtt bevezetnénk a szolubilizációs stratégiába.
A szolubilizáció sikerét minden denaturálószer esetében befolyásolja a redukálószer jelenléte és koncentrációja, az idő, a hőmérséklet, az ionerősség és a denaturálószer és a fehérje aránya. Az inklúziós testek szolubilizációjának kísérleti kiindulási pontjait lásd a 10.2. táblázatban. A szolubilizált fehérjék gyakran már ebben a szakaszban tisztíthatók olyan elválasztási technikával, amely kompatibilis a denaturálószer jelenlétével. A tisztítás és az újraformázás gyakran kombinálható ugyanabban a tisztítási lépésben, például kromatográfiás oszlopon történő újraformázással.
Egyre több alternatív szolubilizációs protokollt is közzétettek (pl. REFOLD adatbázis). A lehetőségek közé tartozik az SDS (10%), az N-laurilszarkozin vagy más detergensek és szélsőséges pH-értékek használata.
A szolubilizált rekombináns fehérjék újraformázása
A szolubilizációt követően a fehérjéket megfelelően újra kell hajtogatni, hogy visszanyerjék funkciójukat. A denaturáló szereket mindig el kell távolítani, hogy lehetővé váljon a fehérje újraformázása és a megfelelő intramolekuláris társulások kialakulása. Az újraformázás során a kritikus paraméterek közé tartozik a pH, a redukáló reagensek jelenléte (gyakran egy gyenge redukálószer redukált és oxidált formáinak keveréke, pl., glutationt használnak), a denaturálószer eltávolításának sebessége, valamint az újrafóliázandó fehérje tisztasága. A 10.3. táblázat összehasonlítja az újrafóliázás hagyományos módszereit az oszlopon történő affinity purifikációval és újrafóliázással.
Az újrafóliázás általában kiterjedt optimalizálást igényel. Mindig mérlegelni kell más alternatívákat is (mint korábban említettük), például az expressziós paraméterek optimalizálását, új konstrukció készítését vagy az expressziós gazda megváltoztatását.
Az oszlopon történő újraformázás
A hisztidinnel jelölt fehérje használata lehetővé teszi egy egyszerű, de hatékony tisztítási és oszlopon történő újraformázási eljárás alkalmazását, amely a kívánt biológiai aktivitást mutató oldható fehérjét eredményez. A 10.1 ábrán látható protokollt sikeresen alkalmaztuk több különböző hisztidin-jelölt fehérje esetében.

10.1. ábra.Általános séma az E. coli sejtekben befogadó testként előállított (hisztidin)6-taggal ellátott fehérjék extrakciójára, szolubilizálására és újraformázására.
A hisztidinnel jelölt fehérjék erős kötődését az immobilizált kétértékű fémionokhoz nem zavarja meg a kaotróp szerek (például karbamid vagy Gua-HCl) magas koncentrációja. Következésképpen a (hisztidin)6-jelölt fehérjék kaotróp extrakcióval szolubilizálhatók és Ni Sepharózhoz köthetők. A szennyező fehérjék eltávolítása és az újraformázás nem denaturáló pufferfeltételekre való cserével elvégezhető a fehérje oszlopról történő elúciója előtt.
A visszahajtás után a fehérje bármely más kromatográfiás technikával tovább tisztítható, mint bármely natív fehérje esetében (8. fejezet, Purification of protein A-tagged proteins), ha nagyobb tisztasági fok szükséges.
A helyesen hajtogatott fehérjék elemzése
A 10.4. táblázat összefoglalja a fehérjék helyes hajtogatásának értékelésére használt különböző technikákat.
Alkalmazás
Purifikáció és oszlopon történő újraformázás egy oldhatatlan hisztidin-jelzett fehérje 100 ml-es E. coli kultúrából HisTrap FF 1 mL és ÄKTAprime plus használatával
Ez az eljárás HisTrap FF 1 mL oszlopot használ, de használható HisTrap HP 1 mL vagy HisTrap FF crude 1 mL oszlopon is.
A pufferek előkészítése
Nagy tisztaságú vizet és vegyszereket használjon, és használat előtt minden puffert 0,45 µM filteren kell átengedni.
Alternatív kötőpufferek: A nem hisztidinnel jelölt fehérjék nem specifikus kötődésének csökkentése érdekében 5-40 mM imidazolt lehet a kötőpufferbe tenni. Az imidazol koncentrációja fehérjefüggő, és ha a kívánt fehérje egy bizonyos imidazol-koncentrációnál eluálódik vagy nem kötődik, csökkentsük a koncentrációt.
A zárványtestek felbontása, mosása és izolálása
- Rezuszpendálja a 100 ml tenyészetből származó sejtpasztát 4 ml reszuszpendáló pufferben.
- A sejteket szonikációval, jégen (pl., 4 × 10 s).
- Centrifugálás nagy sebességgel 10 percig 4 °C-on.
- Vegyük ki a felülúszót, és szuszpendáljuk újra a pelletet 3 mL hideg izolálópufferben. Szonikáljon a fentiek szerint.
- Centrifugáljon nagy sebességen 10 percig 4 °C-on.
- Ismételje meg a 4. és 5. lépést.
Ebben a szakaszban a pelletanyagot egyszer át lehet mosni karbamidot nem tartalmazó pufferben, és fagyasztva tárolni a későbbi feldolgozáshoz.
Szolubilizálás és mintaelőkészítés
- Rezuszpendálja a pelletet 5 ml kötőpufferben.
- Keverjük 30-60 percig szobahőmérsékleten.
- Centrifugáljuk 15 percig nagy sebességen, 4 °C-on.
- A maradék részecskéket távolítsuk el a minta 0.45 µM filteren.
A β-merkaptoetanol optimális koncentrációját (0-20 mM) minden egyes fehérje esetében kísérleti úton kell meghatározni.
Ha nem a fentiek szerint készült, akkor a mintát a kötőpuffer összetételéhez igazítsa kötőpufferben való hígítással vagy puffercserével, sótalanító oszlop segítségével (11. fejezet, Sótalanítás/puffercsere és koncentráció), majd a mintát 0.45 µM filtert.
A rendszer előkészítése
Ha lineáris gradiensképzést választunk az újraképzéshez és az elúcióhoz, akkor a kromatográfiás rendszer használata elengedhetetlen.
Ez a példa az ÄKTAprime plus-t használja. A rendszer előkészítése után a további lépések (az Alkalmazási sablon kiválasztása és a módszer indítása című résznél) automatikusan végrehajtódnak.
- Az A portból (8 portos szelep) származó minden egyes bemeneti csövet helyezze az eluensekbe a fent megadott módon, a B portból (2 portos szelep) származó csövet pedig az elúciós pufferbe.
- A három barna hulladékcsövet helyezze a hulladékba.
- Csatlakoztassa az oszlopot az injektáló szelep (7-portos szelep) 1. portja és az UV flow-cella közé.
- Töltse meg a frakciógyűjtő állványt 18 mm-es csövekkel (legalább 40), és helyezze a frakcionáló karon lévő fehér lemezt a firmacsőhöz.
- Csatlakoztasson egy, a minta számára elég nagy mintahurkot az injektáló szelep 2. és 6. portja közé. Használjon fecskendőt a hurok kézzel történő fillesztéséhez.
Megjegyzés: Ha Superloop™-ra van szükség, további információkat a Superloop használati utasításában talál.
Az alkalmazássablon kiválasztása és a módszer elindítása
- Ellenőrizze a PrimeView-val való kommunikációt. A képernyő jobb alsó sarkában a Controlled By: prime szövegnek kell megjelennie.
- A nyíl és az OK gombokkal addig mozogjon a menüfában, amíg find Az oszlopon történő újrahajtás HisTrap.

3. Adja meg a minta mennyiségét, és nyomja meg a OK gombot a sablon elindításához.

10.2. ábra.Elméleti gradiens az oszlopon történő visszahajtogatásban HisTrap alkalmazás sablonja

10.3. ábra.Egy hisztidinnel jelölt fehérje oszlopon történő újraformázása.
Szűrési feltételek az IMAC segítségével történő újraformázáshoz
A 96 lyukú MultiTrap lemezek hasznos termékek az IMAC újraformázási feltételek szűrésére (10.5. táblázat). Ebben a példában a szolubilizált, fel nem hajtogatott fehérjét a His MultiTrap FF lyukakba adagoltuk. A fehérjéket különböző refolding pufferekben inkubáltuk, és meghatároztuk a refolding mértékét (10.4. ábra). A hasonló szűrési kísérletekből származó optimális pufferek felhasználhatók a HisTrap FF-en történő oszlopon történő visszaalakítás skálázásához.
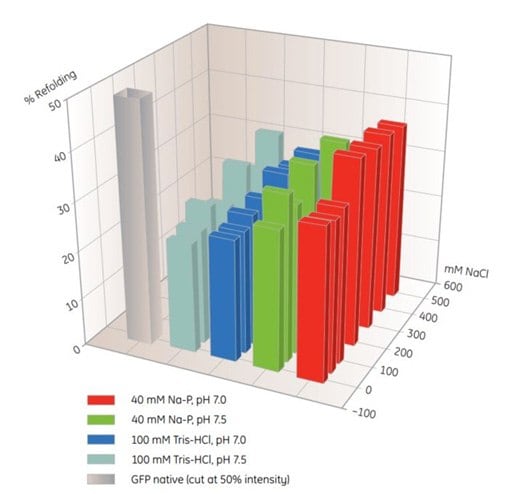
Ábra. 10.4.Az IMAC visszaalakítási feltételek szűrése hisztidin-jelölt GFP-re His MultiTrap™ FF használatával. Ez a kezdeti szűrés pufferanyagokra, pH- és sókoncentrációkra terjedt ki. Az adatokat J. Buchner, M. Haslbeck és T. Dashivets (Müncheni Műszaki Egyetem, Németország) bocsátotta rendelkezésünkre.
Az olvasás folytatásához jelentkezzen be vagy hozzon létre egy felhasználói fiókot.
Még nem rendelkezik fiókkal?