Testy toku iontových kanálů a protokoly
Assaye iontových kanálů pro měření toku iontů přes draslíkové kanály
Iontové kanály jsou rozhodující pro regulaci mnoha signálních drah v buňkách, přičemž mnoho iontových kanálů vylaďuje elektrické signály, které jsou důležité pro řadu buněčných funkcí. Jelikož iontové kanály hrají klíčovou roli v buněčných signálních dějích, jsou jak cílem léčiv, tak místem mnoha necílových účinků léčiv. Posouzení toho, jak léky modulují funkci iontových kanálů, je tedy zásadní pro vývoj léků a bezpečnost pacientů. Tato technická zpráva poskytuje jednoduchou, vysoce výkonnou metodu měření toku iontů draslíkovými iontovými kanály, která je snadno přizpůsobitelná pro chlorid sodný a protonové kanály a byla využita mnoha laboratořemi1-3. Tento test, který může zahrnovat použití umělých liposomů, lze použít ve vysoce výkonných screenech k identifikaci účinků léčiv na iontové kanály1. Běžně se také používá k posouzení funkčnosti purifikovaných membránových proteinů používaných ve strukturních studiích a je zlatým standardem pro stanovení lipidové regulace iontových kanálů2. Další informace a informace o produktech pro iontové kanály naleznete na naší stránce Iontové kanály nebo si prohlédněte náš Stránka s informacemi o přípravě liposomů.
Fluorescenční testy toku sodíkových nebo draslíkových iontových kanálů
Při tomto testu se purifikované iontové kanály rekonstituují do liposomů obsahujících vysokou koncentraci (100-400 mM) vodivého iontu (K+, Na+). Tyto liposomy se poté zředí do reakčního pufru, který vnější ionty osmoticky kompenzuje, aby se vytvořil elektrochemický gradient. Protonový ionofor (CCCP) zajišťuje cestu pro protony proti odtoku iontů v přítomnosti vodivého kanálu. Odtok protonů je pak monitorován membránově propustným barvivem ACMA citlivým na pH. Při neutrálním pH má ACMA jasnou fluorescenci. Při protonizaci však ACMA zhasne a přestane být membránově propustný.

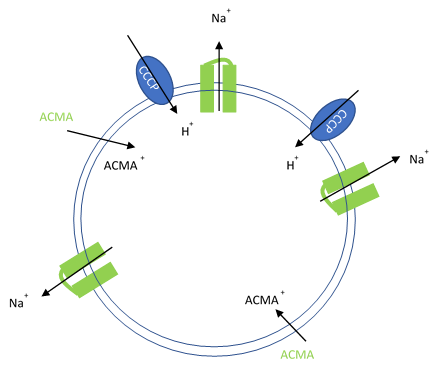
Obrázek 1. Umělé liposomy obsahující protonové ionofory (CCCP) pro protony k potlačení odtoku draselných nebo sodných iontů a membránou propustné citlivé barvivo ACMA je využito k monitorování odtoku protonů.
Po dosažení rovnováhy mezi tokem iontů a protonů (5-30 minut) se měří dostupný objem liposomů přidáním valinomycinu nebo monensinu, který poskytuje na kanálech nezávislou cestu pro vedení K+ nebo Na+ . Při tvorbě lipozomů lze přidávat molekuly nebo lipidy a hodnotit jejich aktivační nebo inhibiční vliv. Příkladové údaje naleznete na obrázku 2 s draslíkově selektivním Kirbacem a kationtově selektivním NaK kanálem.


Obrázek 2. Údaje o vzorcích využívajících fluorescenční tokové testy ke zkoumání toku draslíku nebo sodíku v umělých liposomech.
Údaje o toku draslíku nebo sodíku ve vzorku demonstrují spojení vnitřní změny pH s tokem iontu pórem a lze je snadno upravit pro testování vedení mnoha typů iontů v závislosti na rekonstituovaném kanálu. Například liposomy rekonstituované s vysokým obsahem Na lze použít k testování aktivity Na kanálu. Tento test lze použít pro K, Na, H, Cl kanály použitím správných ionoforů a úpravou pořadí přidávání CCCP a ionoforů.
Příprava proteoliposomu
Lipidy hrají klíčovou roli v regulaci iontových kanálů, ale tuto regulaci je obtížné kvantitativně vyhodnotit v buněčném kontextu. Proteolipozomy vytvořené v tomto testu lze připravit s různými lipidy, což umožňuje provádět kvantitativní experimenty týkající se lipidové regulace iontových kanálů4. Další zdroje naleznete na stránka o přípravě lipozomů.
Metody tvorby lipozomů
Lipozomy lze tvořit několika způsoby v závislosti na následujících potřebách: Velikost šarže, podmínky skladování lipidů, požadavky na skladování a aktivita bílkovin. Tři nejběžnější způsoby tvorby liposomů jsou dialýza, Amberlite® resin nebo gelová filtrace, přičemž každý z těchto tří způsobů poskytuje jedinečné výhody a nevýhody.
Dialýza: Dialýza s použitím malé molekulové hmotnosti umožňuje výměnu malých volných molekul detergentu s větším objemem dialýzy (1000x dialýza). Navíc, protože lipidy se v roztoku nevyměňují, zůstanou v dialyzační hadičce a vytvoří proteoliposomy. Doporučuje se provádět dialýzu nad teplotou přechodu lipidů. Tato metoda funguje nejlépe pro detergenty s vysokou CMC a je méně účinná pro detergenty, jako je Triton X-100 a DDM s velmi nízkou CMC. Ačkoli je tato metoda považována za šetrnou metodu rekonstituce a může dobře fungovat u křehkých proteinů, jedná se o časově náročný proces s nutností několika výměn pufru a obvykle vyžaduje noční krok. Rychlost odstraňování detergentu je obtížně kontrolovatelná a může vést k horší reprodukovatelnosti liposomů.
Amberlite®: Polystyrenové kuličky (Amberlite® XAD®-2) obsahující malé hydrofobní póry absorbují širokou škálu detergentů a běžně se používají pro přípravu liposomů5. Množství přidaného přípravku Amberlite® určuje míru absorpce detergentu a obvykle se přidává v malých dávkách1, přičemž celkový obsah je přibližně 30 mg kuliček/mg detergentu. Některé lipidy a proteiny mohou být absorbovány do Amberlite®, avšak jejich velká velikost brání výrazné absorpci. Tato metoda je relativně rychlá a absorpce je dokončena během několika hodin. Přidání stejného poměru Amberlite® k detergentu povede ke konzistentní tvorbě liposomů. Tato metoda je změnitelná pro malé i velké dávky a relativně snadno se při ní vytvářejí vzorky paralelně.
Gelová filtrace: Tato metoda je nejrychlejší a nejefektivnější způsob tvorby proteolipozomů, vzorky jsou hotové do 20 minut od zahájení, takže je užitečná, když je potřeba mnoho vzorků2. Velké liposomy rychle procházejí kolonami Sephadex G-25, zatímco volné detergenty se zpomalují difuzí do pórů. Použití komerčně dostupných kolon Sephadex pomáhá při vytváření konzistentních lipozomů, protože velikost kolony hraje důležitou roli při konečné velikosti a čistotě proteolipozomů. Jednou z nevýhod je, že se vzorek během běhu ředí, takže pokud je třeba znát přesnou koncentraci proteinu, je třeba ji kvantifikovat. Do kolony se také vstřebávají některé lipidy.
Tvorba lipozomů pomocí gelové filtrace a reagencií pro protokol fluorescenčního testu
- PD SpinTrap™ G-25 nebo 96jamková destička
- Pufr pro rozpouštění lipidů: Chaps 35 mM, 450 mM KCl , 10 mM HEPES, 4 mM NMDG a 0,5 mM EGTA, pH 7,4
- Pufr pro fluorescenci uvnitř: Vnější pufr: 20 mM Hepes, 1 mM EDTA, 450 mM KCl, pH 7,4
- Výtok vnějšího pufru:
- 1000X zásoba ACMA: 2 mM ACMA v DMSO
- 200X 0.4 mM CCCP v DMSO
- 200X 4 uM Valinomycin v DMSO
- 200X 5 mM Monensin v DMSO
- Černá 96jamková destička
.Protokol gelové filtrace pro tvorbu liposomů
- Kolonky PD SpinTrapTM G25 ekvilibrujte podle pokynů pufrem Flux inside (20 mM Hepes, 1 mM EDTA, 450 mM KCl, pH 7.4)
- Smíchejte 1-10 μg 1 mg/ml solubilního membránového proteinu se 100 μl 10 mg/ml POPE:POPG solubilizovaného v 35 mM Chaps ,450 mM KCl, 10 mM HEPES, 4 mM NMG a 0,5 mM EGTA, pH 7,4 a nechte 20 min ekvilibrovat na ledu nebo při pokojové teplotě. K 10 mg/ml POPE:POPG přidejte také stejný objem pufru obsahujícího detergent s membránovým proteinem, abyste vytvořili kontrolu prázdných liposomů.
- Osušte kolonu Sephadex® odstřeďováním na 800 g 1 min.
- Na střed ekvilibrované kolony PD Spintrap G25 naložte 100 μl směsi protein:detergent. Přidejte 40 μl stohovacího toku uvnitř pufru.
- Spinuji naloženou spinovou kolonu 800xg po dobu 2 min a shromáždím průtok, který obsahuje naložené proteoliposomy v pufru s vysokým K.
Protokol stanovení toku na základě fluorescence
- Naložit 10 μl proteolipozomů obsahujících vysokou koncentraci iontů na 96jamkovou destičku
- Podrobněji popsáno./li>
- Přidejte 10 μl 1000X ACMA do 10 ml fluxového vnějšího pufru
- Přidejte 190 μl fluxového vnějšího pufru do černé 96jamkové destičky obsahující proteoliposomy a promíchejte.
- Sbírejte 10 časových bodů počáteční fluorescence ACMA, excitace 419 nm emise 490 nm
- Přidejte 1 μl 200X CCCP a rychle promíchejte a sbírejte fluorescenci, dokud se tok nevyrovná (5-30 min)
- Přidejte 1 μl 200X CCCP a rychle promíchejte a sbírejte fluorescenci, dokud se tok nevyrovná (5-30 min)
- Přidejte 1 μL 200X Valinomycinu (draselný) nebo Monensinu (sodný) a rychle sbírejte fluorescenci po dobu 10 časových bodů
- Vypočítejte celkový tok pomocí této rovnice
Vypočítejte celkový tok pomocí této rovnice
Flux= (Flux v časovém bodě N - Flux Final) / (Flux Initial - Flux Final)
Optimalizace a skladování proteoliposomů:
Proteiny uložené v lipidové dvojvrstvě jsou obecně mnohem stabilnější než v detergentech, což umožňuje dlouhodobé skladování proteoliposomů. Mnoho proteinů v proteolipozomech lze zmrazit a dlouhodobě skladovat při teplotě -80 °C, ale po rozmrazení je nejlépe otestovat, zda nedošlo ke ztrátě funkce. Proteolipozomy vytvořené třemi metodami odstraňování detergentů mají různou velikost a mohou být směsí multilamelárních a unilamelárních vezikul. Signál testu toku závisí na velikosti a unilamelární povaze lipozomů, přičemž větší unilamelární vezikuly mají větší kapacitu toku. Pokud mají kanály použité v těchto experimentech nízký tok nebo vodivost, doporučuje se provést některé úpravy po vytvoření lipozomů, které jsou popsány níže.
Zmrazení a rozmrazení:
Pro vytvoření unilamelárních proteolipozomů se lipozomy rychle zmrazí (obvykle v kapalném dusíku) a rozmrazí nad jejich přechodovou teplotu. Tento proces lze několikrát opakovat, přičemž každý cyklus zmrazení a rozmrazení vede ke vzniku menších, ale více unilamelárních proteolipozomů. Zmrazování a rozmrazování se osvědčuje zejména při experimentech, které vyžadují mnoho vzorků, protože je lze provádět paralelně.
Extruze:
Unilamelární proteolipozomy lze vytvořit protlačením přes polykarbonátové filtry s definovanou velikostí pórů. To lze provést pomocí LiposoFast Liposome Factory s póry od 100-400 nm. Tento postup je však časově náročný a pravděpodobně není vhodný pro experimenty s mnoha jednotlivými liposomy.
Reference
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?