Purifikace z neklonovaného buněčného lyzátu pomocí HisTrap™ FF Crude
HisTrap™ FF crude je kolona připravená k použití, předbalená Ni Sepharose® 6 Fast Flow, pro purifikaci rekombinantních proteinů značených histidinem. Po důkladném rozrušení buněk je možné naložit neklonovaný, surový buněčný lyzát přímo na kolonu bez nutnosti centrifugace a filtrace vzorku.
Přímé naložení neklonovaných buněčných lyzátů zkracuje celkovou dobu purifikace a může zvýšit možnost purifikace citlivých cílových proteinů bez ztráty jejich aktivity.

Obrázek 3.14.Kolony HisTrap™ FF crude umožňují jednoduchou purifikaci proteinů značených histidinem v jednom kroku bez nutnosti předúpravy vzorku, jako je odstřeďování a filtrace.
Kolony HisTrap™ FF crude jsou vyrobeny z polypropylenu, který je biokompatibilní a neinteraguje s biomolekulami. Kolony se dodávají se zátkou na vstupu a s odcvakávacím koncem na výstupu. Kolony mají porézní polyethylenové horní a spodní frity s velikostí pórů optimalizovanou pro nakládání neklarifikovaných buněčných lyzátů přímo na kolonu, aniž by docházelo k problémům se zpětným tlakem nebo k úniku kuliček Ni Sepharose® 6 Fast Flow. Kolony lze provozovat pomocí injekční stříkačky a dodaného konektoru Luer, peristaltické pumpy nebo chromatografického systému, jako je ÄKTA. Všimněte si, že kolony HisTrap™ FF crude nelze otevřít ani refillovat.
Viz obrázek 3.15 schéma protokolu pro HisTrap™ FF crude ve srovnání s konvenčním IMAC.

Obrázek 3.15.Kolony HisTrap™ FF crude šetří čas při purifikaci proteinů značených histidinem ve srovnání s konvenční IMAC.
Příprava vzorku a pufru
Obecný postup přípravy vzorku a pufru naleznete v Purifikaci pomocí Ni Sepharose® 6 Fast Flow dříve v této kapitole.
Při přímém nakládání neklarifikovaného vzorku je rozhodující dosáhnout efficientní lýzy buněk, aby se předešlo problémům se zpětným tlakem. Neklarifikovaný lyzát naneste na kolonu přímo po přípravě.
Je-li vzorek příliš viskózní, zřeďte jej vazebným pufrem, aby nedošlo k ucpání kolony; zintenzivněte lýzu (sonikace, homogenizace); nebo přidejte DNázu/RNázu, abyste zmenšili velikost fragmentů nukleových kyselin.
Pokud sonikovaný nebo homogenizovaný neklarifikovaný buněčný lyzát před použitím zmrazíte, může dojít ke zvýšení precipitace a agregace. Nová sonikace lyzátu pak může zabránit problémům se zvýšeným protitlakem při nakládání na kolonu.
Purifikace
- Naplňte hadičku pumpy nebo stříkačku destilovanou vodou. Odstraňte zátku a připojte kolonu k hadičce chromatografického systému, stříkačce (použijte dodaný konektor Luer) nebo laboratorní pumpě "po kapkách", abyste zabránili vniknutí vzduchu do systému.
- Odstraňte zacvakávací koncovku na výstupu kolony.
- Vymyjte etanol 3 až 5 objemy destilované vody.
- Ekvilibrace kolony nejméně 5 objemy vazebného pufru. Doporučené rychlosti fluktuace jsou 1 ml/min, resp. 5 ml/min pro kolony o objemu 1 ml, resp. 5 ml.
- Pomůckou nebo stříkačkou aplikujte neklarifikovaný lyzát. Typické objemy náplně neklonovaného lyzátu (vysoce závislé na specifickém vzorku, předúpravě vzorku a teplotě při nakládání vzorku):
- HisTrap™ FF crude 1 ml: Až 100 ml
- HisTrap™ FF crude 5 ml: až 500 ml
Upozorňujeme, že vazebná kapacita pro proteiny může také omezovat množství vzorku, které lze použít.
V průběhu nakládání vzorku se doporučuje jeho nepřetržité míchání, aby se zabránilo sedimentaci. Zavádění vzorku při teplotě 4 °C může zvýšit viskozitu vzorku. Nepříznivým účinkem zvýšené viskozity vzorku je, že maximálního protitlaku pro kolonu je dosaženo při nižším objemu vzorku, který je na koloně zatížen. Velké objemy mohou zvýšit protitlak, což ztěžuje použití injekční stříkačky.
- Proplachujte vazebným pufrem, dokud absorbance nedosáhne ustálené základní hodnoty (obvykle alespoň 10 až 15 objemů kolony).
- Eluujte elučním pufrem pomocí krokového gradientu nebo lineárního gradientu. Pro postupnou eluci obvykle postačuje 5 objemů elučního pufru na koloně. Mělký gradient, například lineární gradient na 20 nebo více objemů kolony, může oddělit proteiny s podobnou vazebnou silou.
- Po eluci regenerujte kolonu promytím 5 až 10 objemy vazebného pufru. Kolona je nyní připravena pro novou purifikaci stejného cílového proteinu.
Kolonu není třeba mezi jednotlivými purifikacemi svlékat a znovu nabíjet, pokud se bude purifikovat stejný protein. Opakované použití jakékoli purifikační kolony závisí na povaze vzorku a mělo by se provádět pouze s identickými označenými proteiny, aby se zabránilo křížové kontaminaci. Další informace k tomuto tématu a k čištění a skladování naleznete na Příloha 1 (Charakteristiky Ni sefarosy, Ni sefarosy® excelu, TALONu)sup>® Superflow a nenabité IMAC Sefarosa® produkty).
Nezabarvené lyzáty mohou při purifikaci způsobit zvýšenou tvorbu vzduchových bublin. Pokud to způsobuje problémy, může tomu zabránit připojený omezovač flow v chromatografickém systému. Pokud je připojen omezovač flow, je důležité změnit limit tlaku na 0,5 MPa (5 barů) v systému ÄKTA (kde kolona a omezovač flow dávají tlak 0.3 MPa a 0,2 MPa).
Ni Sepharose® je kompatibilní s redukčními činidly. Doporučujeme však před použitím pufru/vzorku, který obsahuje redukční činidla, odstranit veškeré slabě vázané ionty Ni2+ . Toho lze dosáhnout provedením slepého pokusu bez redukčních činidel (viz níže). Nenechávejte ani neskladujte surové kolonky HisTrap™ FF s pufry, které obsahují redukční činidla.
Únik Ni2+ z Ni sefarosy® je za všech běžných podmínek nízký. U velmi kritických aplikací lze únik během purifikace ještě více snížit provedením slepého běhu (jak je popsáno níže) před vložením vzorku.
Slepý běh:
Použijte vazebný pufr a eluční pufr bez redukčních činidel.
- Promyjte kolonu 5 objemy destilované vody (pro odstranění 20% etanolu)
- Promyjte kolonu 5 objemy elučního pufru.
- Ekvilibrace pomocí 10 objemů kolonky vazebného pufru.
Příklady použití
1. Purifikace histidinem značeného proteinu exprimovaného v nízkých hladinách v Pichia pastoris pomocí surového materiálu HisTrap™ FF
HisTrap™. FF crude kolony jsou vhodné pro purifikaci histidinem značených proteinů exprimovaných v nízkých hladinách z hostitelů, jako je Pichia pastoris. Pomocí hrubých kolon HisTrap™ FF lze získat vysoce čistý protein přímo z neklonovaných lyzátů P. pastoris.
Obrázek 3.16 ukazuje purifikaci histidinem značené hydrolázy z Saccharomyces cerevisiae exprimované v nízkých hladinách v P. pastoris. Neklasifikovaný vzorek byl vložen přímo na kolonu HisTrap™ FF crude o objemu 5 ml bez jakéhokoli odstřeďování nebo filtrování vzorku. Čistota proteinu z neklarifikovaného vzorku byla vysoká, jak bylo stanoveno pomocí SDS-PAGE.

Obrázek 3.16.(A) c ze Saccharomyces cerevisiae exprimovaný v P. pastoris na HisTrap™ FF crude 5 ml. (B) SDS-PAGE za neredukujících podmínek (ExcelGel SDS Gradient 8-18) ukazuje vysokou čistotu získaného proteinu s nízkou hladinou exprese.
2. Škálování z 1 ml na 5 ml surové kolony HisTrap™ FF
Byl proveden experiment pro škálování z 1 ml na 5 ml surové kolony HisTrap™ FF. Vzorkem byl neklarifikovaný E. coli extrakt obsahující MBP-(His)6, který byl před naložením na kolonu připraven enzymatickou lýzou v kombinaci s homogenizací. Vzorky obsahovaly přibližně 8 a 40 mg MBP-(His)6 pro kolonu o objemu 1 ml a 5 ml.
Po chromatografii (obrázek 3.17A a 3.17B) byla provedena analýza SDS-PAGE. Z ní vyplývá (obrázek 3.17C), že čistota a výtěžnost (mg proteinu/ml média) histidinem značeného proteinu purifikovaného na obou kolonách byla téměř identická.
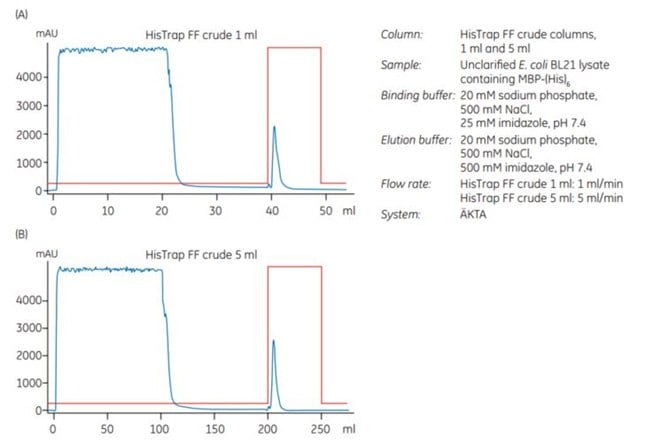
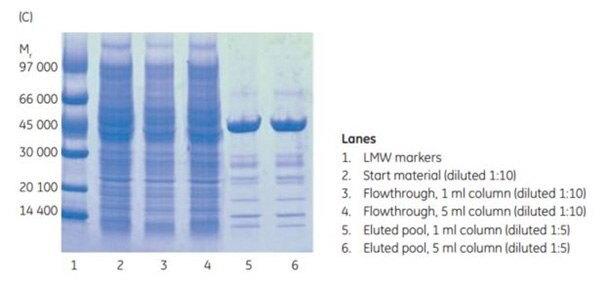
Obrázek 3.17.Rozšíření z (A) 1 ml na (B) 5 ml kolony HisTrap™ FF crude. Výtěžnost bílkovin byla 6,3 a 35,2 mg pro 1 ml a 5 ml kolony. (C) SDS-PAGE za neredukujících podmínek (ExcelGel SDS Gradient 8-18) potvrzuje, že zvýšení z 1 ml na 5 ml kolony nemá významný vliv na výsledek purifikace.
3. Automatizovaná dvoufázová purifikace pomocí HisTrap™ FF crude
Kolonky HisTrap™ FF crude jsou vhodné pro provoz na systémech ÄKTA, jako je ÄKTAxpress, pro vysoce výkonnou purifikaci proteinů značených histidinem. ÄKTAxpress umožňuje automatizovanou, paralelní purifikaci proteinů značených histidinem s možností provádět řadu různých vícekrokových protokolů. Průvodce metodou dodávaný s řídicím softwarem UNICORN umožňuje snadno vytvářet metody pro různé purifikační protokoly. Obrázek 3.18 ukazuje automatizovanou dvoukrokovou purifikaci neklonovaného lyzátu E. coli obsahujícího MBP-(His)6. Prvním krokem v purifikačním protokolu byl AC s použitím kolony HisTrap™ FF crude o objemu 1 ml. Eluovaný pík z affinačního kroku byl automaticky shromážděn do smyčky a znovu vstříknut na kolonu HiLoad™ 16/60 Superdex 75 pg SEC ve druhém kroku purifikace. Čistota proteinu ve frakcích z kroku SEC byla potvrzena pomocí SDS-PAGE (obrázek 3.18B).
Výsledky ukazují, že HisTrap™ FF crude spolu s ÄKTAxpress usnadňuje a umožňuje významnou úsporu času při purifikaci proteinů značených histidinem, aniž by byla ohrožena čistota vzorku.

Obrázek 3.18.(A) Automatizovaná dvoustupňová purifikace MBP-(His)6 z neklonovaného lyzátu E. coli pomocí HisTrap™ FF crude a HiLoad 16/60 Superdex 75 pg na ÄKTAxpress. (B) SDS-PAGE byla provedena za neredukujících podmínek na ExcelGel SDS Gradient 8-18.
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?