Análise de extraíveis de PFAS em produtos de filtração usando o EPA 537.1 modificado
Clique nos links abaixo para navegar para as seções:
- Contaminantes em testes de PFAS
- Testando filtros de seringa de PES e náilon Millex® com amostras de água usando o EPA 537.1 modificado
- Testando filtros de membrana de polipropileno Millipore® com amostras de água usando o EPA 537.1 modificado
- Produtos de filtração recomendados
Contaminantes em testes de PFAS
Uma consideração fundamental para qualquer método de PFAS é evitar a contaminação que possa afetar a exatidão dos dados, inclusive a contaminação decorrente de técnicas de preparo de amostras, como a filtração. Atualmente, a maioria dos métodos analíticos de PFAS se destina a matrizes "limpas", como de água potável, e muitas vezes não exigem filtração como parte do preparo de amostras. No entanto, métodos como o SW-846 Método 8327, ASTM D7968, ASTM D7979, EPA 1633 e ISO 21675 envolvem matrizes que podem ter um grau mais alto de partículas, como águas residuais. É necessário remover as partículas da solução antes da LC-MS/MS, pois elas podem ser prejudiciais à análise das amostras, à longevidade da coluna e ao funcionamento geral do instrumento. Esses métodos identificam a necessidade de filtração usando membranas em um formato de filtro de seringa.
Um método EPA 537.1 modificado foi usado para demonstrar que os filtros de seringa de polietersulfona (PES) e náilon Millex® e as membranas de polipropileno Millipore® não exibem níveis detectáveis de contaminantes PFAS resultantes de extraíveis fluorados.
Testando filtros de seringa de PES e náilon Millex® com amostras de água usando o EPA 537.1 modificado
Materiais e métodos
Três lotes de dispositivos de filtro de seringa de polietersulfona (PES), três lotes de náilon e dois lotes de náilon-HPF (membrana de náilon com um pré-filtro de fibra de vidro para filtração de amostras com alto grau de partículas) Millex® foram testados quanto a extraíveis de PFAS de acordo com o Método EPA 537.1. Alguns compostos de PFAS não exigidos pelo método, incluindo compostos de PFAS de próxima geração e sulfonatos fluorotelômeros, também foram incluídos. O EPA 537.1 não exige a filtração de amostras, mas a filtração foi usada para fornecer uma amostra limpa a fim de testar os níveis de contaminação de extraíveis do filtro de seringa.
Uma visão geral do método EPA 537.1 está descrita no fluxo de trabalho abaixo, com as condições da LC-MS/MS incluídas na Tabela 1. Resumidamente, uma amostra de água desionizada livre de PFAS de 250 ml foi enriquecida com substitutos. Um enriquecimento de padrão interno de 0,08 ppb foi usado para os brancos de CQ. Para determinar se o meio de filtração de amostras contribui para a contaminação por PFAS, a amostra inteira foi passada pelo filtro e inserida em um cartucho para SPE de estireno-divinilbenzeno (SDVB). Os frascos e tubos de amostra foram enxaguados com metanol básico, depois passados pelo filtro e inseridos no cartucho. Em seguida, a amostra inteira foi submetida à SPE e concentrada a 1 ml em metanol:água a 96:4% (v/v) antes da análise por LC-MS/MS usando uma coluna C18. A análise foi realizada usando padrões internos. Foram usados padrões marcados com C-13 usados neste estudo. Os filtros testados incluíram: três lotes de filtros de seringa GP Millex® (não estéril, filtro de 33 mm com membrana de PES Millipore Express® PLUS) com tamanho de poro de 0,22 µm (N.° do cat. SLGP033N) e 0,45 µm (N.° do cat. SLHP033N), três lotes de filtros de seringa de náilon Millex® (não estéril, filtro de 33 mm com membrana de náilon) com tamanho de poro de 0,20 µm (N.º do cat. SLGN033N) e dois lotes de filtros de seringa de náilon-HPF Millex® (não estéril, filtro de 25 mm com membrana de náilon e pré-filtro de fibra de vidro) com tamanho de poro de 0,20 µm (N.º do cat. SLGNM25).
Fluxo de trabalho do método usado para o EPA 537.1 modificado:
Fluxo de trabalho


Filtrar
As amostras são filtradas usando um filtro de seringa Millex®.
Extração em fase sólida
Os analitos são extraídos da amostra por extração em fase sólida (SPE).
Concentração
Os extratos são concentrados por evaporação com nitrogênio usando um banho-maria.
LC-MS/MS
Os extratos concentrados são analisados por LC-MS/MS.
Resultados
Não foram detectados contaminantes PFAS em nenhum dos dispositivos Millex® testados usando o EPA 537.1 modificado acima dos limites de relato (RL) ou dos limites mínimos de detecção (MDL), mesmo considerando os limites muito baixos de 0,0020–0,0080 ppb e 0,0010–0,0020 ppb, respectivamente, dependendo do composto (Tabela 2). Os resultados foram os mesmos para os três lotes diferentes de membranas de PES de 0,22 e 0,45 µm, três lotes diferentes de membranas de náilon de 0,20 µm e dois lotes diferentes de membranas de náilon-HPF de 0,20 µm. Esses resultados sugerem que os dispositivos de filtração de PES, náilon e náilon-HPF Millex® são confiáveis e adequados para uso na filtração de amostras de água no preparo para a análise desses compostos de PFAS.
Recuperação
Neste estudo, os tubos de amostra e os frascos de amostra foram enxaguados com metanol básico. As recuperações dos padrões marcados com C-13 estavam dentro do intervalo de CQ aceitável para o método. No entanto, a recuperação variou de material do filtro para material do filtro (Figura 1) e de composto para composto. Por exemplo, os dispositivos de filtro à base de náilon apresentaram recuperações mais baixas do que os dispositivos de PES. No caso das membranas de náilon, a adsorção não específica dos padrões enriquecidos internamente e da amostra pode ser reduzida usando um enxágue com metanol. Resultados semelhantes foram obtidos usando somente membranas de PES (sem carcaça e filtradas usando um dispositivo de suporte de filtro Swinnex® de 25 mm).
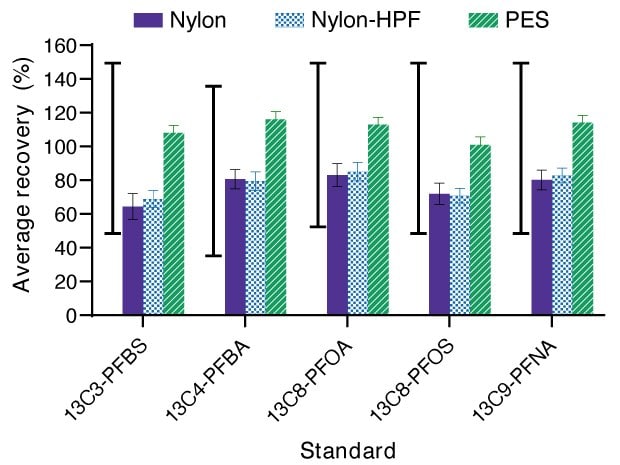
Figura 1.A recuperação percentual média dos padrões marcados com C-13 para PFBS, PFBA, PFOA, PFOS e PFNA após a filtração com dispositivos de filtro de seringa Millex® de náilon (roxo, média ± desvio padrão [STDEV], n = 9 réplicas em 3 lotes), náilon-HPF (azul com padrão xadrez, média ± STDEV, n = 6 réplicas em 2 lotes) e PES (verde com barras horizontais, média ± STDEV, n = 9 réplicas em 3 lotes). O intervalo de CQ aceitável para a recuperação dos padrões internos é indicado pela linha preta contínua delimitada à esquerda de cada composto.
Testando filtros de membrana de polipropileno Millipore® com amostras de água usando o EPA 537.1 modificado
Os dispositivos de filtro de seringa são o formato mais recomendado e preferido para a filtração de amostras para análise por LC-MS/MS de PFAS devido à facilidade de uso e à variedade de pequenos volumes que podem ser processados (10–100 ml). No entanto, em alguns casos, os filtros de seringa podem não ser a melhor opção para a filtração; por exemplo, quando não há filtros de seringa adequados para uma aplicação específica disponíveis no mercado. Nesses casos, é necessário considerar uma alternativa. Um dispositivo semelhante a um filtro de seringa, como um suporte Swinnex®, é uma alternativa viável. Esse dispositivo acionado por pressão acomoda qualquer filtro de membrana de disco cortado de um tamanho específico (13 mm ou 25 mm de diâmetro) e é operado da mesma forma que um filtro de seringa tradicional, transformando assim qualquer material de membrana em um formato de filtro de seringa.
Tanto o ASTM D7979 (para detecção de PFAS em matrizes de água, exceto água potável) quanto o ASTM D7968 (para detecção de PFAS em sólidos ambientais) sugerem o uso de polipropileno para o preparo e filtração de amostras. O polipropileno é um material durável compatível com uma grande variedade de solventes e temperaturas e que apresenta baixo teor de extraíveis, tornando-o apropriado especificamente para a preparação de amostras e fases móveis relacionadas a PFAS. Um desafio do polipropileno é que ele é naturalmente hidrofóbico, o que dificulta a filtração de amostras aquosas. A maioria dos filtros de disco de polipropileno disponíveis no mercado é hidrofóbica, como os filtros de membrana de polipropileno Millipore® (N.º do cat. PPTG04700 e N.º do cat. PPTH04700). Embora seja adequado para solventes como o metanol, filtrar amostras aquosas pode ser um desafio. Em alguns casos, é possível encontrar o polipropileno em um formato hidrofílico (filtros de membrana de polipropileno hidrofílico Millipore®, N.º do cat. PPHG04700 e N.º do cat. PPHH04700). Esses filtros são adequados para lidar com amostras aquosas. Assim, percebendo o potencial do material de polipropileno para ser usado no contexto de uma variedade de fluxos de trabalho de PFAS, incluindo filtração da fase móvel, determinamos o nível dos extraíveis de PFAS que esses discos de filtro liberam.
Materiais e métodos
Conjunto do suporte do filtro Swinnex®
Os filtros de membrana de polipropileno (PP) hidrofílico e hidrofóbico Millipore® com tamanhos de poro de 0,2 µm e 0,45 µm foram testados quanto ao teor de extraíveis de PFAS. Os dispositivos Swinnex® (25 mm de diâmetro) foram usados para transformar os vários filtros de membrana de disco em um dispositivo de filtro de seringa tipo Luer-lock, de acordo com a Figura 2. Uma vez montado, o dispositivo Swinnex® pode ser conectado a um barril de seringa Luer-lock com o material a ser filtrado. Em seguida, a filtração foi realizada da mesma forma que em outros dispositivos de filtro de seringa. Para cada réplica do disco, um dispositivo Swinnex® novo e limpo foi usado.

Figura 2A.Colocação do anel de vedação do tipo O-ring

Figura 2B.Manipulação do filtro

Figura 2C.Colocação do filtro

Figura 2D.Fixação da junta

Figura 2E.Suporte do filtro Swinnex® montado
EPA 537.1 modificado
Nesta parte do estudo, quatro tipos de filtros de membrana de disco cortado de 25 mm foram testados:
- PP hidrofóbico de 0,2 µm (N.º do cat. PPTG02500)
- PP hidrofóbico de 0,45 µm (N.º do cat. PPTH02500)
- PP hidrofílico de 0,2 µm (N.º do cat. PPHG02500)
- PP hidrofílico de 0,45 µm (N.º do cat. PPHH02500)
Depois que cada filtro de membrana de disco cortado foi colocado firmemente em um dispositivo Swinnex®, 250 ml de amostras de água enriquecidas com substitutos foram passados por cada filtro e inseridos em um cartucho para SPE de estireno-divinilbenzeno (SDVB) usando o EPA 537.1 para matrizes de água potável como diretriz. A amostra inteira foi submetida à SPE e concentração, de acordo com os procedimentos descritos no fluxo de trabalho acima. Foi executada a LC-MS/MS com uma coluna C18 de acordo com as condições incluídas na Tabela 1 e a análise foi realizada usando padrões internos para determinar se havia níveis de extraíveis presentes nos filtros de membrana de disco cortado de PP. Foi testado um lote (n = 3 filtros por lote) por tipo de membrana.
É importante observar que é difícil fazer a água pura fluir através dos filtros de membrana de disco cortado de PP hidrofóbico; portanto, para obter um melhor fluxo de água para essas amostras, os filtros de membrana de disco cortado foram pré-umedecidos em metanol antes de filtrar 250 ml de água. Não foi necessário pré-umedecer os filtros de membrana de disco cortado de PP hidrofílico.
Resultados
Assim como constatado para os dispositivos de filtro de seringa Millex®, não foram detectados contaminantes PFAS em nenhum dos filtros de membrana de disco cortado de polipropileno de acordo com o EPA 537.1 modificado acima do RL, variando de 0,0020–0,0080 ppb, ou do MDL, variando de 0,0010–0,0020 ppb (Tabela 3). Isso indica que essas membranas não têm extraíveis de PFAS nesses limites e podem ser usadas para aplicações de PFAS em que a filtração é necessária para o preparo de amostras.
No entanto, somente para as membranas de polipropileno hidrofóbico, foram observados quatro compostos (ácido perfluoro-n-dodecanoico [PFDoDA], ácido perfluoro-n-tridecanoico [PFTrDA], ácido perfluoro-n-tetradecanoico [PFTeDA] e ácido acético N-etil perfluorooctano sulfonamida [N-EtFOSAA]) em que não foram detectados compostos de PFAS, mas os padrões associados de 13C2-PFDoA, 13C2-PFTeDA e D5-NEtFOSAA apresentaram recuperações fora dos limites de controle de 40–140%, 30–130% e 40–140%, respectivamente. Esses compostos apresentaram recuperações médias de aproximadamente ~15–25% (para PFDoDA, PFTrDA e PFTeDA) e 30–33% (para N-EtFOSAA). Isso indica que a adsorção não específica desses compostos no polipropileno hidrofóbico pode ser significativa em água. Considerando os comprimentos de cadeia longos e os grupos funcionais volumosos desses compostos, existe um potencial de ocorrerem interações hidrofóbicas e estéricas com os meios de filtração e outros consumíveis. É interessante observar que as recuperações de polipropileno hidrofílico permaneceram dentro dos intervalos dos limites de controle para todos os compostos, indicando que a hidrofilização do material da membrana reduziu quaisquer interações não específicas com os padrões de PFAS.
Recuperação
Membranas de polipropileno hidrofóbico versus hidrofílico
Em amostras de água, as membranas de polipropileno hidrofílico testadas apresentaram uma recuperação dos padrões internos dentro do intervalo de CQ, ao contrário das membranas hidrofóbicas (Figura 3). As recuperações de 13C2-PFDoDA, 13C2-PFTeDA e D5-EtFOSAA apresentaram consistentemente uma recuperação fora do intervalo de CQ para polipropileno hidrofóbico, dificultando a quantificação do teor real de PFAS desses compostos. Dado que o PFDoDA, o PFTeDA e o PFTrDA são moléculas de PFCA de cadeia longa, a perda observada pode ser decorrente de impedimentos estéricos e interações hidrofóbicas com o material da membrana ou da carcaça do Swinnex®.
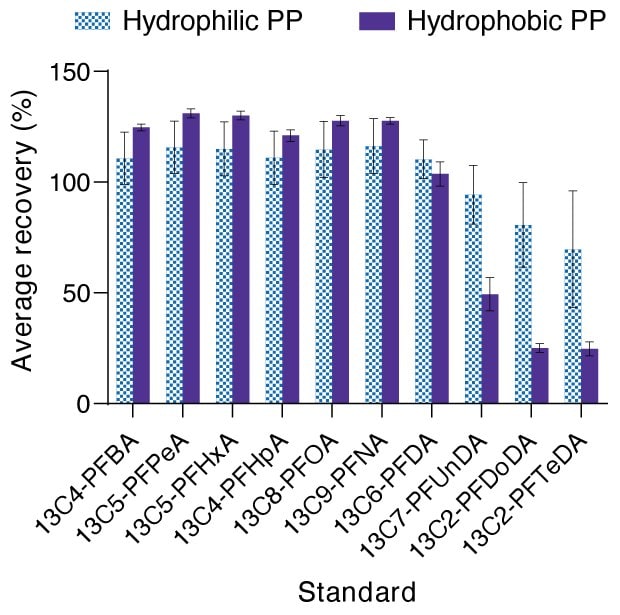
Figura 3.A recuperação percentual média dos padrões marcados com C-13 para filtros de membrana de disco cortado de polipropileno hidrofílico versus hidrofóbico em água, somente para a classe de ácidos carboxílicos perfluoroalquilados de PFAS. Os valores são a média ± desvio padrão, n = 3 réplicas. O intervalo de CQ para os padrões varia de acordo com o composto, da esquerda para a direita: 35–135% (13C4-PFBA), 50–150% (13C5-PFPeA até 13C6-PFDA), 40–140% (13C2-PFDoDA), 30–130% (13C2-PFTeDA).
Para continuar lendo, faça login ou crie uma conta.
Ainda não tem uma conta?