COHISR-RO
Roche
Resina de purificação com etiqueta His cOmplete™
suspension, suitable for protein purification, matrix Sepharose-CL 6B
About This Item
Produtos recomendados
forma
suspension
embalagem
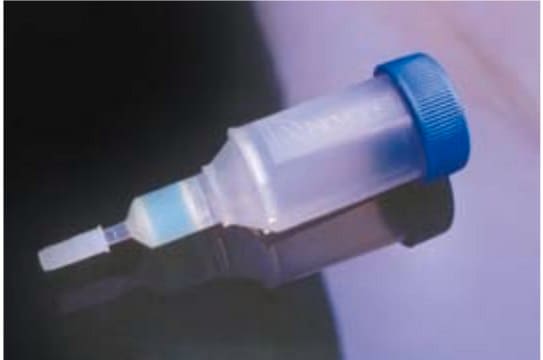
pkg of 200 mL (05893801001 [settled resin volume])
pkg of 25 mL (05893682001 [settled resin volume])
fabricante/nome comercial
Roche
técnica(s)
protein purification: suitable
matriz
Sepharose-CL 6B
temperatura de armazenamento
2-8°C
Categorias relacionadas
Descrição geral
Capacidade de ligação: ≥ 40 mg de proteína por ml de volume de leito. A capacidade de ligação da resina a vários tipos de proteínas pode variar de acordo com as características da proteína, como o tamanho da proteína. As colunas de purificação com etiqueta His cOmplete se ligam com uma alta especificidade à proteína marcada com poli-histidina. Como consequência, a cinética de ligação pode parecer diferente quando comparada com as matrizes de quelante metálico convencionais. A capacidade total das colunas de purificação com etiqueta His cOmplete pode ser alcançada permitindo que a proteína se ligue à resina por mais tempo, por meio da redução da taxa de fluxo durante o procedimento de purificação por cromatografia.
Taxa de fluxo linear máxima: 1,420 cm/hora
Taxa de fluxo volumétrico recomendada: A taxa de fluxo volumétrico é uma função da seção transversal da coluna. Usando a fórmula a seguir, uma taxa de fluxo linear pode ser convertida em um fluxo volumétrico (ml/min.): Taxa de fluxo linear (cm/hora) × área transversal da coluna (cm2)/60. A área da seção transversal da coluna é definida como Π× r2, enquanto Π é a constante pi e r é o raio interno da coluna.
Concentração recomendada de imidazol por carga/lavagem: A ligação inespecífica de proteínas sem uma etiqueta His é baixa. Use imidazol até 5 mM em tampões de carregamento e/ou lavagem. Se estiver determinando um novo ensaio para purificação de proteínas etiquetadas com His com as colunas de purificação com etiqueta His cOmplete, não use imidazol. Se, por exemplo, a pureza da proteína marcada com His precisar ser melhorada após esta primeira etapa, use imidazol em uma concentração final de até 5 mM em uma segunda etapa.
Concentração recomendada de imidazol por eluição: Até 500 mM. Observação: Diferentemente de outras resinas disponíveis, a proteína etiquetada com His ligada tipicamente elui das colunas de purificação com etiqueta His cOmplete com uma menor concentração de imidazol, por exemplo, de 25 a 45 mM.
Compatibilidade para armazenamento de longo prazo: etanol 20%, pH 4,0 a pH 9,0
Compatibilidade durante a cromatografia: A resina é compatível com EDTA 10 mM, DTT 10 mM durante a purificação (incubação por 1 hora), cloridrato de guanidina 6M, ureia 8M, pH 2,0 a pH 14,0.
Compatibilidade durante a limpeza: SDS 4%
Além disso, a resina mantém sua capacidade de ligação, quer use proteínas de baixo ou alto peso molecular, e sua especificidade possibilita uma purificação em uma única etapa. Usando um dos quelantes mais fortes disponíveis, garante-se mínima contaminação de suas frações de fluxo passante com íons metálicos, salvaguardando suas aplicações a jusante.
A resina de purificação com etiqueta His cOmplete também está disponível em um formato pré-embalado: com 1 ml ou 5 ml de resina.
Aplicação
Purificar uma proteína de interesse é muitas vezes essencial para determinar sua função, estrutura ou interações, para ativar anticorpos específicos ou preparar enzimas para aplicações práticas. O isolamento de proteínas expressas naturalmente de sua fonte original pode ser um processo complexo, envolvendo várias etapas cromatográficas. A expressão de proteínas recombinantes em organismos hospedeiros específicos pode simplificar muito essa tarefa. Esses sistemas de expressão. de modo geral, garantem níveis de expressão mais altos. A fusão da proteína-alvo com uma etiqueta também confere capacidade de ligação vantajosa a uma matriz de afinidade.
Purificação de proteínas usando Ni2+ imobilizado
A técnica mais comum na purificação por afinidade de proteínas envolve inserir uma sequência de 6 a 14 histidinas na terminação N ou C (ou mesmo em uma alça exposta) da proteína. Tais trechos de poli-histidina se ligam fortemente a íons metálicos bivalentes, como níquel e cobalto. Este efeito pode ser usado para separar proteínas. Íons metálicos podem ser imobilizados em uma matriz usando um quelante, que ainda permite que o íon interfira com a etiqueta de poli-histidina da proteína. Quando essas proteínas marcadas com his passam por uma coluna contendo íons metálicos imobilizados, as proteínas se ligam através da etiqueta à coluna. Quase todas as proteínas não etiquetadas passam pela coluna. A proteína é liberada da coluna por eluição com imidazol, que compete com a etiqueta de poli-histidina pela ligação à coluna, ou por uma diminuição do pH, que diminui a afinidade da etiqueta pela resina. Embora este procedimento seja, de modo geral, usado para a purificação de proteínas recombinantes com uma etiqueta de afinidade inserida, ele também pode ser usado para proteínas naturais com uma afinidade inerente por cátions bivalentes.
Etiquetas His
Idealmente, a proteína-alvo etiquetada com His se liga muito mais fortemente à matriz quelada com Ni2+ que a proteína endógena contendo histidina do hospedeiro de expressão. A força de ligação relativa depende de quantas histidinas podem se ligar simultaneamente à matriz (efeito de avidez). Etiquetas His mais longas conferem uma ligação mais forte e uma melhor separação do alvo de proteínas hospedeiras possivelmente contaminantes. A etiqueta His clássica tem seis histidinas consecutivas. Etiquetas com 10 a 14 histidinas podem produzir melhor purificação. Mais importante, as proteínas marcadas com His podem ser purificadas usando matrizes queladas com Ni2+ em condições nativas e desnaturantes. Devido a sua natureza hidrofílica e flexível, essas matrizes aumentam a solubilidade das proteínas-alvo e raramente interferem na função proteica. Esta combinação única de recursos permite que a etiqueta His seja uma ferramenta versátil para diversas aplicações de purificação de proteínas.
Características e benefícios
- Use as condições tamponantes mais adequadas para a sua proteína: Mantenha sua proteína adequadamente e deixe que ela, e não a sua resina de purificação, determine se você deve usar DTT, EDTA ou outras substâncias tamponantes.
- Obtenha proteína altamente pura repetidamente: Purificação em uma etapa única, sem recarga de resina.
- Proteja sua proteína contra níquel tóxico: Reduza a oxidação e agregação de proteínas causadas por resinas que lixiviam níquel.
- Trabalhe em um ambiente seguro e ecológico: Evite manipular níquel tóxico e elimine completamente os custos de descarte.
forma física
Outras notas
Informações legais
Palavra indicadora
Warning-Warning
Frases de perigo
Classificações de perigo
Flam. Liq. 3
Código de classe de armazenamento
3 - Flammable liquids
Classe de risco de água (WGK)
WGK 1
Ponto de fulgor (°F)
93.2 °F
Ponto de fulgor (°C)
34 °C
Certificados de análise (COA)
Busque Certificados de análise (COA) digitando o Número do Lote do produto. Os números de lote e remessa podem ser encontrados no rótulo de um produto após a palavra “Lot” ou “Batch”.
Já possui este produto?
Encontre a documentação dos produtos que você adquiriu recentemente na biblioteca de documentos.
Os clientes também visualizaram
Artigos
Get maximum protection after protein isolation by using protease and phosphatase inhibitor cocktail tablets from Roche.
Protocolos
cOmplete™ His-Tag Purification Resin Protocol & Troubleshooting
Nossa equipe de cientistas tem experiência em todas as áreas de pesquisa, incluindo Life Sciences, ciência de materiais, síntese química, cromatografia, química analítica e muitas outras.
Entre em contato com a assistência técnica