MAB1562
Anti-Prion-Proteinantikörper, AS 109–112, Klon 3F4
clone 3F4, Chemicon®, from mouse
Synonym(e):
PrP, CD230
About This Item
Empfohlene Produkte
Biologische Quelle
mouse
Qualitätsniveau
Antikörperform
purified immunoglobulin
Antikörper-Produkttyp
primary antibodies
Klon
3F4, monoclonal
Speziesreaktivität
hamster, human
Hersteller/Markenname
Chemicon®
Methode(n)
ELISA: suitable
immunohistochemistry (formalin-fixed, paraffin-embedded sections): suitable
immunoprecipitation (IP): suitable
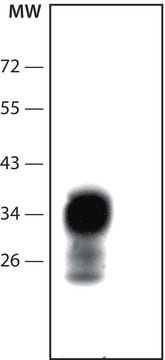
western blot: suitable
Isotyp
IgG2a
NCBI-Hinterlegungsnummer
UniProt-Hinterlegungsnummer
Versandbedingung
dry ice
Posttranslationale Modifikation Target
unmodified
Angaben zum Gen
human ... PRNP(5621)
Allgemeine Beschreibung
Spezifität
Immunogen
Anwendung
Repräsentative Bilder aus einer früheren Charge. Optimale Färbung mit Citratpuffer, pH 6,0, Epitop-Rückgewinnung: Menschliches Gehirn
Immunhistochemie (Kitamoto et al., 1987):
1:100-1:1,000 *Siehe Protokoll unten.
Das Epitop muss im fixierten Gewebe durch eine Vorbehandlung des Gewebes mit einem der folgenden Verfahren erneut exponiert werden:
a. Ameisensäure 10 Minuten lang bei Raumtemperatur (Kitamoto et al., 1987)
b. hydrolytisches Autoklavieren (Kitamoto et al., 1991)
c. Erhitzung in der Mikrowelle (BioGenex, San Ramon, CA)
Western Blot: (Kascsak, R.J., 1991; Kascsak, R.J., 1987):
Es wurde eine Verdünnung von 1:10.000–1:100.000 einer früheren Charge verwendet.
Immunpräzipitation: (Kascsak, R.J., 1991; Kascsak, R.J., 1987):
Es wurde eine Verdünnung von 1:10–1:100 einer früheren Charge verwendet.
ELISA: (Kascsak, R.J., 1991; Kascsak, R.J., 1987):
Es wurde eine Verdünnung von 1:100.000 einer früheren Charge verwendet.
Die optimalen Arbeitsverdünnungen müssen vom Endanwender bestimmt werden.
Qualität
Prion-Protein (Kat.- Nr. MAB1562) Färbemuster/Morphologie in normalem Gehirn. Gewebe wurde mit Citrat, pH 6,0, vorbehandelt. Diese Antikörper-Charge wurde im Verhältnis 1:500 mit IHC-Select-Detektionsreagenz mit HRP-DAB verdünnt. Immunreaktivität zeigt sich vorwiegend als Zellkörperfärbung von Neuronen.
Optimale Färbung mit Citratpuffer, pH 6,0, Epitop-Rückgewinnung: Menschliches Gehirn
Zielbeschreibung
Physikalische Form
Rechtliche Hinweise
Not finding the right product?
Try our Produkt-Auswahlhilfe.
Lagerklassenschlüssel
12 - Non Combustible Liquids
WGK
WGK 2
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.