膜蛋白通常以蛋白-脂質-去垢劑複合物的形式進行純化。複合物在水性環境中的溶解度允許應用與水溶性蛋白質基本相同的分離技術。主要的差異在於膜蛋白的純化是在所有溶液中都含有去垢劑的情況下進行的。這是必要的,因為蛋白質-去垢劑複合物是動態的,在沒有游離去垢劑的情況下,會立即失去去垢劑分子。去垢劑濃度應高於 CMC,但可保持在比溶解過程中使用的濃度低 10 倍左右(通常在 0.1% 的範圍內)。
高濃度的去垢劑會降低蛋白質的穩定性。但是,如果膜成分的濃度很高,在溶解過程中去垢劑的濃度就需要很高。一旦溶解完成,去垢劑濃度就可以降低。
過度純化會導致蛋白質-脂質去垢劑複合物中的重要脂質被去除,同時導致蛋白質活性的損失。
在整個純化過程中,在所有緩衝液中加入 5%的甘油通常可以提高膜蛋白的穩定性。
組氨酸標記膜蛋白的純化組氨酸標記蛋白質對 Ni2+ 和其他幾種金屬離子有親和力,可以使用螯合配體固定在色層介質上。因此,含有組氨酸標記的蛋白質會選擇性地與帶有金屬離子電荷的介質結合,如 Ni Sepharose High Performance (HP) 和 Ni Sepharose 6 Fast Flow (FF),而大多數其他細胞蛋白質不會結合或結合較弱。透過增加咪唑濃度可達到洗脫效果。 水溶性、(組氨酸)6標記蛋白通常可按照標準方案直接純化。組氨酸標記的膜蛋白有時問題較多,常有報告指出膜蛋白與 IMAC 媒介的結合力較弱。據推測,這是由於組氨酸標記與 IMAC 配體的接觸性受到限制,這是由於去垢劑與蛋白質結合所致。為了解決這個問題,較長的組氨酸標籤通常用於膜蛋白的過度表達。此外,組氨酸標籤和目標膜蛋白之間的連結物,例如綠色螢光蛋白 (GFP),也被建議用來改善與 IMAC 媒介的結合。
歷史上,組氨酸標籤膜蛋白的純化通常採用批次式純化。批次式純化包括將樣品與層析介質在開放的容器中混合一段指定的時間,通常是過夜。然後將懸浮液裝入色譜柱中進行洗滌,並洗掉結合的蛋白質。由於吸附時間較柱分離長,批次純化有時可提高產量。另一方面,由於分批處理的時間較長,蛋白質更容易受到蛋白水解降解或失活,因此可能會影響純化蛋白質的品質。
組氨酸標記膜蛋白的純化也可以使用柱基方法進行。
根據最終應用所需的純度水平,可以在 IMAC 之後進行其他純化步驟。為此,凝膠萃取可能是最常見的方法,其優點是通常不需要最佳化。也可以使用陰離子交換層析法,而且通常包含在 IMAC 與凝膠萃取步驟之間。
Purification of Histidine-tagged Membrane Protein from the Solubilized, Isolated Membrane Fraction Material<
材料
色譜柱:HisTrap HP, 1 mL
結合緩衝液:PBS, 20 mM imidazole, 0.1 to 1 % detergent (e.g., DDM), pH 7.4
洗脱緩衝液:PBS, 0.5 M imidazole, 0.1 to 1% detergent (e.g.、
樣品製備
在 5 mL 溶解的膜蛋白中,加入 0.20 mL 洗脱緩衝液,使最終的咪唑濃度為 20 mM。
此純化程序應在 4 °C 下進行。
- 在注射器或泵管中注入蒸餾水。取下瓶塞,將色谱柱與注射器(使用隨附的接頭)、實驗室泵或色譜系統 「滴對滴 」連接,以避免將空氣引入系統。
- 用 3 至 5 個柱容量 (CV) 的蒸餾水洗去乙醇。
- 用 10 個柱容量 (CV) 的結合緩衝液以 1 mL/min* 的流速平衡色譜柱
- 上樣(使用與 Luer 接頭連接的注射器或用泵將樣品注入色譜柱)。流速為 1 mL/min。
- 用 10 CV 結合緩衝液清洗,流速為 1 mL/min。
- 用 0% 至 75% 緩衝液梯度洗滌,流速為 1 mL/min,洗滌液濃度為 20 CV。
- 洗脱后,用 5 CV 100%洗脱缓冲液清洗色谱柱,然后用 5 CV 结合缓冲液清洗。
*使用带有 HiTrapTM 1-mL 色谱柱的注射器时,1 mL/min 相当于约 30 滴/分钟。使用較大的色譜柱時,可使用較高的流速。
此程序可以通過串聯兩個或三個色譜柱或使用 HisTrap HP 5 mL 色譜柱來擴大。
建議使用相對較低的 NaCl 濃度(例如 PBS 為 150 mM NaCl),因為膜蛋白在較高的離子強度下往往溶解度較低。對於水溶性蛋白質的 IMAC,通常建議使用較高的濃度 (例如 300 至 500 mM NaCl),以減少污染物與層析介質之間的離子相互作用。在某些情況下,對於膜蛋白,甚至應該使用更低的 NaCl 濃度 (例如 150 mM)。
據報導,如上述方案,從 IMAC 柱使用梯度洗脫(咪唑濃度增加),可分離出僅脂質含量不同的蛋白質-脂質-去垢劑複合物。
在上述步驟 5 之後,重新使用穿流材料,讓樣品通過 IMAC 層析柱幾次,可以有效提高產率。
在樣品加載過程中降低流速也可以提高產率。
為了進一步純化,離子交換層析和(或)凝膠過濾通常是合適的方法(請參閱本節中的「其他純化步驟」 )。
圖 1.9顯示了使用上述方案純化 YedZ-TEV-GFP-(His)8 的過程。YedZ是大腸桿菌的轉運器膜蛋白,在大腸桿菌中以融合蛋白的形式過度表達,融合蛋白有GFP、C-端(組氨酸)8 標記和煙草侵蝕病毒(TEV)蛋白酶裂解序列。
結合緩衝液:PBS, 20 mM imidazole, 0.1 to 1 % detergent (e.g., DDM), pH 7.4
洗脱緩衝液:PBS, 0.5 M imidazole, 0.1 to 1% detergent (e.g.、
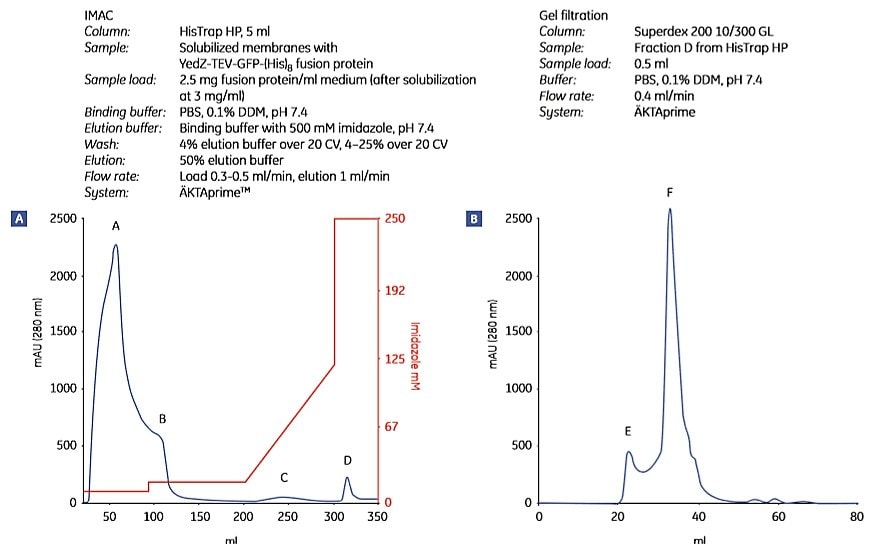
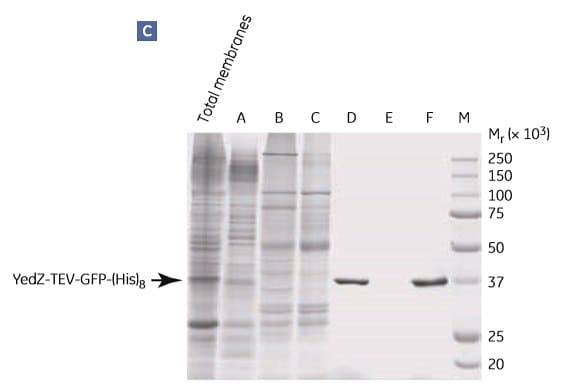
圖 1.9.大腸桿菌YedZ-TEV-GFP-(His)8從大腸桿菌細胞培養製備的溶解膜中分兩步純化。(A) IMAC 的餾分經由 (B) 凝膠過濾進一步純化。(C) SDS-PAGE 分析顯示目標蛋白的純度。來自 HisTrap HP 膠柱的餾分 D 基本上是均勻的。M = 分子重量標記。峰 E 很可能含有光散射去垢劑-脂質聚集體。數據由瑞典斯德哥爾摩大學生物膜研究中心 David Drew 博士提供。
直接從粗溶解的大腸桿菌裂解物中提取組氨酸標記的膜蛋白
本方案避免了膜制備和離心的需要。
材料
色谱柱:HisTrap FF crude, 1 mL
Binding buffer:PBS, 40 mM imidazole, 0.1% detergent (e.g., DDM), pH 7.4
洗脱緩衝液: PBS, 1 M imidazole, 0.1% detergent (e.g.、DDM), pH 7.4
樣品製備
將 E.大腸桿菌細胞糊狀物,每克糊狀物加入 5 mL 含有 40 mM 咪唑的 PBS。通過溶菌酶處理和聲納進行細胞裂解(表 1.2)。從濃縮濃縮液(例如:DDM,最終濃度為 0.8%)中加入去垢劑至未裂解的裂解液中。在冰上攪拌 1.5 小時。
製備
- 在泵管或注射器中注入蒸餾水。取下塞子,將色谱柱與色譜系統管、注射器(使用提供的 Luer 接頭)或實驗室泵 「滴對滴 」連接,以避免將空氣引入系統。
- 用 3 到 5 CV 的蒸餾水洗去乙醇。
- 用 10 CV 的結合緩衝液以 1 mL/min 的流速平衡色譜柱*
- 用泵(0.5 mL/min)或注射器注入去垢劑處理過的未澄清裂解液。未clarified裂解液的加載量很大程度上取決於每個特定樣品。
*使用HiTrap 1-mL柱的注射器時,1 mL/min約相當於30滴/min。當使用更大的色譜柱時,可以使用更高的流速。請參閱色譜柱使用說明
建議在上樣期間持續輕輕攪拌樣品,以防止沉澱。在4 °C下上樣會增加樣品的粘度。樣品黏度增加的一個不利影響是,色譜柱會在較低的樣品容量下達到最大背壓。
- 視樣品容量而定(較大樣品容量需要較大的洗滌容量),用 10 到 30 CV 的結合緩衝液以 1 mL/min 的流速進行洗滌。
- 以 1 mL/min 的流速,在 10 CV 內用 0% 至 12% 的洗脱缓冲液梯度洗脱,然後在 5 至 10 CV 內用 12% 至 100% 的洗脱缓冲液梯度洗脱。
- 洗脱后,用 5 CV 洗脱缓冲液清洗色谱柱,然后用 5 CV 结合缓冲液清洗色谱柱。
圖 1.10顯示了使用上述方案純化 YedZ-TEV-GFP-(His)8 的結果。
為了進一步純化,離子交換層析和凝膠過濾通常是合適的方法(請參閱本節中的「額外純化步驟」)。
該步驟可以通過串聯兩個或三個色譜柱或使用 HisTrap FF crude 5 mL 色譜柱來擴大。

圖 1.10.使用 HisTrap FF 粗品(1 mL)直接從粗溶解的大腸桿菌裂解物中純化(組氨酸)8 標記的膜蛋白 YedZ-TEV-GFP-(His)8。用 SDS-PAGE 分析峰值馏分 14 和 15。掃描凝膠以偵測融合蛋白的 GFP 部分。箭頭指示與 YedZ-TEV-GFP-(His)8 相對應的帶。色谱图中,蓝色 =A280;橙色 = A425(检测 YedZ);绿色 = A485(检测 GFP);灰色 = 电导率;红色 = % 洗脱缓冲液。過度表達向量由瑞典斯德哥爾摩生物膜研究中心的 J.-W. deGier 博士提供。
額外的純化步驟
對於需要高純度均質物質的應用(例如結構特性分析),IMAC 釋出的組氨酸標記膜蛋白的進一步純化通常是必要的。通常只需一到兩個額外的層析步驟即可。為了達到最高的效率,應設計純化方案,以便在不同步驟中使用不同的分離原理。
高效的純化方案可能包括 IMAC(依據規格分離),接著是脫鹽和離子交換(依據電荷差異分離),最後是凝膠過濾(依據大小差異分離)。凝膠過濾最常用於最後一步,以去除聚集物,並將樣品轉移到適合進一步進行功能和結構研究的緩衝液中。分離是在洗滌劑高於 CMC(通常約 0.1%)的情況下進行。其他條件與水溶性蛋白相同。一些合適的色譜柱列於表1.6ÄKTAxpress™色譜系統可用於自動化多步驟純化,以最少的操作時間生產出高純度的蛋白質。
高分辨率阴离子交换可用于纯化和表征纯化膜蛋白的电荷均一性。圖 1.14顯示使用 Mono Q™ 純化的 IMAC 膜蛋白的電荷特性。

圖 1.14.使用 Mono Q 陰離子交換色譜法分析組氨酸標記的細胞色素 bo3 ubiquinol 氧化酶的電荷均勻性。使用 PhastGelTM 8-25% 和銀染色進行 PhastSystemTM 電泳分析。M = 低分子量校正試劑盒;E = 大腸桿菌膜的去垢劑提取物;FT = 流動材料;F1 = 來自 HiTrap Chelating HP 1 mL 的馏分 1;F2 = 來自 HiTrap Chelating HP 1 mL 的馏分 2。 請參閱應用說明 18-1128-92 整全膜蛋白的純化與層析特性"。
* 針對可溶性、球狀蛋白質而定。
膜蛋白的溶解度對離子強度可能非常敏感。
膜蛋白的溶解度對離子強度非常敏感,在這種情況下,從離子交換色譜柱鹽梯度洗出的餾分應立即稀釋或在PD-10脫鹽柱、HiTrap脫鹽柱或HiPrep 26/10 脫鹽柱上運行,以降低鹽濃度(例如、
凝膠過濾是最終純化步驟的絕佳選擇,因為它既能去除聚集物,又能在需要時同時進行緩衝液交換。
標籤裂解
如果在標籤和目標蛋白之間插入蛋白酶裂解位點,則可在純化後移除抗體標籤。如果使用ÄKTAxpress系統,柱上裂解協議可以自動執行。蛋白酶的活性會受到去垢劑的影響。不同蛋白酶在去垢劑中的活性的全面數據基本缺乏,但 PreScission™ Protease 和凝血酶都已成功用於去垢劑中。建議使用 SDS-PAGE 檢查不同條件下的裂解程度。
PreScission蛋白酶在4 °C時展現優異的裂解特性,是裂解敏感蛋白的有用替代品。
TEV蛋白酶在9 mM癸基麥芽糖苷中具有完全活性,但在其他幾種去垢劑中有部分活性。
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?