本節涵蓋 IEX 分離過程中每個步驟的詳細內容,以及提高分辨力和整體性能的實用提示和技巧。在實踐中,分離過程可概括如下:
- 用 5-10 個柱容量的起始緩衝液平衡色譜柱,或直到基線、洗滌液 pH 值和電導率穩定為止。
- 將樣品調整到所選的起始 pH 值和離子強度,並應用到色譜柱上。
- 使用5-10柱容量的起始緩衝液進行洗滌,或直到基線、洗出液pH值和電導率穩定,即所有未結合物質均已洗過柱為止。或者(如果沒有梯度製作設備)使用 5 柱容量的起始緩衝液 + NaCl 以所選的離子強度洗脫結合蛋白。
- 用 5 柱容量的 1 M NaCl(100%B)洗柱,以洗脱任何剩余的离子结合物质。
- 用 5-10 柱容量的起始缓冲液重新平衡,或直到洗脱液的 pH 值和电导率达到所需值。
本節將強調這些步驟。
所提及的緩衝液容量以柱容量表示,例如 3 CV=3 mL 表示柱床容量為 1 mL。使用色谱柱体积描述分离曲线有助于方法开发和将方法转移到不同尺寸的色谱柱上。
通过优化,通常可以减少分离过程中每个阶段使用的色谱柱体积数量。例如,平衡強離子交換器所需的緩衝液較少;若能保持解析度,則可減少梯度用量;在分離不太複雜且相當乾淨的樣品時,可能需要較少的緩衝液進行洗滌。
pH 值和離子強度
緩衝液的 pH 值和離子強度必須與蛋白質的穩定性和活性相容。最適合的 pH 值應該能讓感興趣的蛋白質結合,但應盡可能接近釋放(洗出)點。如果 pH 值太低或太高,洗脫就會變得更困難,可能需要高濃度的鹽。
應避免這種情況,因為某些蛋白質在高離子強度下會開始沉澱,而高鹽濃度可能會干擾檢測或後續的色譜步驟。
避免pH值或其他條件的極端變化,以免造成失活甚至沉澱。
為了實現最有效的高分辨率或基團分離,並充分發揮高負載能力,樣品的pH值和離子強度極為重要。理想情況下,樣品應與起始緩衝液處於相同條件(附錄 1,樣品準備,尤其是緩衝液交換與脫鹽,詳情請參閱第 156 頁)。
蛋白質通常在離等電點約 0.5 個 pH 單位時開始從 IEX 媒介中離解,離等電點的離子強度約為 0.1 M。如果使用阴离子交换剂(Q、DEAE 或 ANX),起始缓冲液的 pH 至少应高于目标物质的 pI 5-1 个 pH 单位;如果使用阳离子交换剂(SP 或 CM),起始缓冲液的 pH 至少应低于目标物质的 pI 0.5-1 个 pH 单位。
對於電荷性質未知的樣品,可嘗試以下方法:
- 離子交換器(Q、DEAE 或 ANX)
起始緩衝液:pH 8.0
洗脱緩衝液:起始緩衝液,包括 1 M NaCl,pH 8.0 - 陽離子交換 (S、SP、CM)
起始緩衝液:pH 6.0
洗脱緩衝液:起始緩衝液,包括 1 M NaCl,pH 6.0
附錄 2 有關陰陽離子交換器的揮發性和非揮發性緩衝系統建議。
在可能的情況下,請檢查所選 pH 值和離子強度值的穩定性,尤其是在以恢復生物活性為優先的情況下。
負離子或陽離子交換器
對於核酸等只攜帶負電荷基團的分子,負離子交換器是明顯的選擇。然而,由於蛋白質等分子的淨電荷(攜帶正負電荷的基團)取決於 pH 值,因此選擇的基礎是哪一種交換器和 pH 值可以在樣品穩定性的限制下提供所需的解析度。例如,圖 18 所示的理論蛋白質在等電點以下帶有淨正電荷,可與陽離子交換器結合。在等電點以上,蛋白質帶有淨負電荷,可與負離子交換器結合。但是,該蛋白質僅在 pH 5-8 的範圍內穩定,因此必須使用負離子交換器。

圖 18.選擇合適的 IEX 媒介時的考慮因素
如果樣品成分在等電點以下最穩定,請使用陽離子交換器。
如果樣品成分在等電點以上最穩定,請使用陰離子交換器。
如果在等電點兩側的寬 pH 值範圍內的穩定性都很高,則使用任何一種類型的離子交換器。
強或弱離子交換器
表 3 顯示 IEX 介質上使用的官能基。術語強和弱指的是官能基團的電離狀態隨 pH 變化的程度。強和弱的詞彙並非指官能基團與蛋白質結合的強度。
開始使用強交換器,以便在廣泛的 pH 範圍內進行開發工作。如果相關蛋白質的等電點低於 pH 7.0 或未知,則使用強陰離子交換器 (Q) 來結合相關蛋白質。
在極端 pH 下可達到最高解析度且相關蛋白質在該 pH 下穩定的情況下,使用強交換器。
如果強離子交換器的選擇性不令人滿意,可考慮使用弱交換器,但請記住弱離子交換器的離子交換能力會隨 pH 值變化。因此:
- 由於交換器的電荷損失,樣品負載(結合)能力會隨著 pH 值的增加而變化。
- 由於可能發生的中間形式的電荷互動,分辨率更容易受到流速或樣品負載變化的影響。
- 預測結果(基於樣品成分的已知資訊,如等電點及其淨表面電荷如何隨 pH 變化)可能與實際結果不一致,因為弱離子交換器上帶電基團的數量會隨 pH 變化。
使用弱離子交換器時,請在下列 pH 值範圍內工作,以盡量減少性能變化:
DEAE: pH 2-9
ANX: pH 2-9
CM:pH 6-10
緩衝劑的選擇和製備
緩衝離子
使用足以保持緩衝能力和恆定 pH 的緩衝液濃度,通常為 20-50 mM。
如果要將純化的產品進行凍乾,則使用揮發性緩衝液。
附錄 2 for recommendations on volatile and non-volatile buffer systems for anion and cation exchangers.
在加入所有鹽分和添加劑之後,過濾緩衝液。使用高品質的水和化學品。對於粒度高於 90 μM 的溶液,使用 1 μM 過濾器過濾;對於粒度為 34 μM 的溶液,使用 0.45 μM 過濾器過濾;對於粒度低於 15 μM 的溶液,使用 0.22 μM 過濾器過濾;或當需要無菌或特別乾淨的樣品時,使用 0.22 μM 過濾器過濾。
温度对缓冲液pH值的影响
选择在工作温度下具有适当pKa值的缓冲液。緩衝物質的 pKa 會隨溫度變化。例如 Tris™ 在 0 °C 時的 pKa 值為 8.85,25 °C 時為 8.06,27 °C 時為 7.72。在 4 °C、pH 值為 7.9 時使用 Tris,緩衝能力會非常低,工作 pH 值也會超出緩衝液的有用 pH 值範圍 (pKa + 0.5)。
在與使用溫度相同的溫度下準備緩衝液。
溫度 <10 °C可將由於樣品成分之間的疏水作用而引起的聚集降至最低。在這些較低的溫度下工作可能是使用洗滌劑來提高溶解度的另一種解決方案。
反離子
IEX中使用的反離子(鹽離子)幾乎都是Na<+ 用於陽離子交換,Cl- 用於陰離子交換。
NaCl等鹽具有混沌特性(即使水的極性降低的能力),因此對疏水分子的 「鹽化 」效果較低。這可確保在洗脫過程中獲得最大的溶解度,並提高回收率。如有需要,也可在有機溶劑存在的情況下使用混沌鹽。應避免使用 (NH4)2SO4 或 K3PO4 等鹽類,因為它們在高濃度時最容易造成沉澱。
在某些應用中,可使用其他反離子,例如 Li+、Br-、I-。、I-、SO42-、CH3COO- or
HCOO- 可能會改善甚至改變選擇性,因為它們展現出不同的洗脫強度,但應該注意的是,使用這些離子可能會影響介質的結合能力。
圖 19 顯示使用不同的反離子時,選擇性和解析度會如何改變。
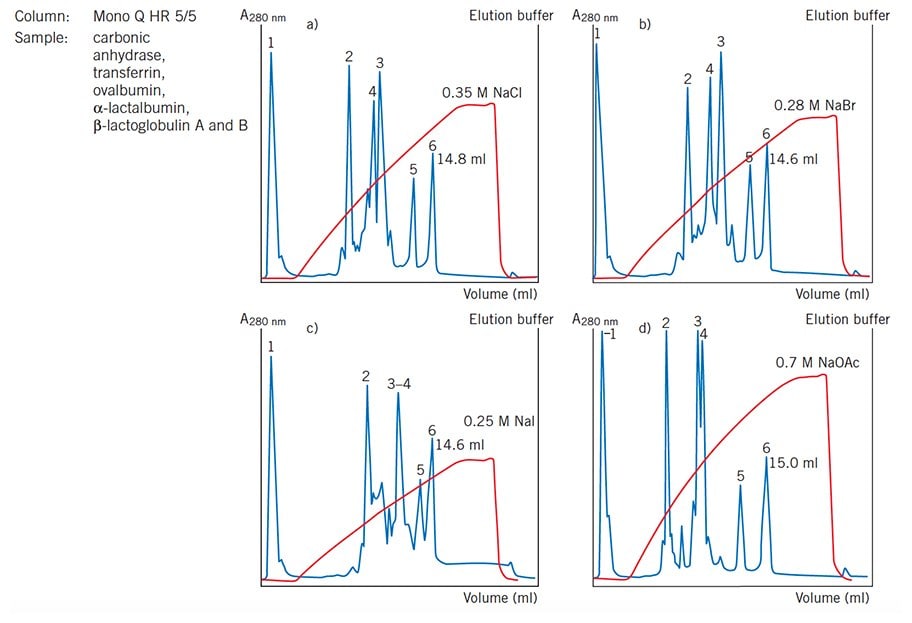
圖 19.反離子對選擇性和解析度的影響(Mono Q HR 5/5現提供Mono Q 5/50 GL)。請注意峰 3 和峰 4 洗出順序的變化。
如果使用的介质中含有钠或氯以外的反离子,请使用以下步骤:
- 用 10 柱体积 0.5-1 M 含有新反离子的盐溶液清洗填充柱。5-1 M 含有新反离子的盐溶液洗涤填料柱。
- 用 10 柱体积的起始缓冲液以与步骤 1 相同的流速洗涤填料柱。
- 重复步骤 1 和 2 多次。
進行空白運行,檢查電導率和 pH 值。
色谱柱和介质制备
用 5-10 柱体积的起始缓冲液平衡色谱柱,或直到基线、洗脱液 pH 值和电导率稳定为止。
強烈建議使用預填充色譜柱,以確保最佳的性能和可重複的結果。均勻填料的色譜柱可確保在樣品通過色譜柱時,成分峰不會不必要地擴大,從而達到最佳解析度。
使用前,讓緩衝液、介質或預填料色譜柱達到相同的溫度。
在使用任何 IEX 媒介之前,請洗去儲存溶液和防腐劑。
如果使用的緩衝液含有洗滌劑或與介質儲存時不同的反離子,則在第一次運行前增加柱平衡所用的容量。填料床所需的容積由需要純化的樣品量和培養基的結合能力決定。
通过确定柱效和峰对称性定期检查色谱柱性能。附錄 3。请注意,这不适用于 HiTrap 或 HiPrep™ 色谱柱。
样品制备
正确的样品和缓冲液制备对于实现最佳分离和避免色谱柱性能下降至关重要。
在應用於色谱柱之前,澄清樣品的簡單步驟可避免堵塞風險,並減少對嚴格清洗程序的需求。
將樣品脫鹽並轉移至所選的起始緩衝液(有關緩衝液交換和脫鹽的詳細資訊,請參閱第 156 頁)。
對於鹽濃度高且沒有脂質或離子去垢劑等主要污染物的小量樣品,使用起始緩衝液稀釋樣品以降低鹽濃度至不干擾與介質結合的水平可能就足夠了。但是,緩衝液交換和脫鹽是保證樣品有正確 pH 值和離子強度條件的唯一方法。
樣品必須清澈且無微粒物質,尤其是在處理粒度為 34 μM 或以下的樣品時。
濃度與黏度
樣品的溶解度或黏度可能會限制可應用於色譜柱的量。樣品黏度過高會造成分離不穩定,以及不規則的流動模式,導致寬廣、扭曲的峰值和背壓問題。關鍵參數是樣品的粘度 相對於 洗出液的粘度。
使用起始緩衝劑稀釋粘稠樣品。如果高粘度是由核酸污染物造成的,請參閱附錄 1 以獲得去除核酸污染物的建議。請記住黏度會隨溫度改變。
樣品的蛋白質含量一般不應超過 50-70 mg/mL,但可能因樣品的類型和層析介質的類型而異。
樣品應用
將樣品調整至所選的起始 pH 值和離子強度(樣品製備),並應用於色譜柱。
使用 5-10 柱容量的起始緩衝液進行洗滌,或直到基線、洗出液 pH 值和電導率穩定,即所有未結合物質均已洗過柱為止。
起始條件應使柱頂附近的目標蛋白質的結合最大化,並在可能的情況下,使污染物的結合最小化,以便它們通過色譜柱。
為了有效結合,樣品的 pH 值和離子強度應與起始緩衝液相同。
為了有效結合,樣品的 pH 值和離子強度應與起始緩衝液相同。樣品容量可以相對較大而不影響分離,因為只要平衡和樣品條件正確,樣品就會結合在色譜柱頂部。
通過色譜系統、蠕動泵或注射器將樣品直接注入色譜柱。設備的選擇在很大程度上取決於樣品量、色譜柱的大小、IEX 介質的類型以及梯度洗脫的精度要求。確保在使用樣品期間,柱床頂部不受干擾
在所有未結合物質通過色譜柱洗滌之前(通過 UV 吸光度監測),以及 UV 值和電導值恢復到起始條件之前,請勿改變緩衝條件。
樣品載量
樣品載量(質量)比樣品容量更重要。可應用於色譜柱的樣品量取決於 IEX 介質的動態結合能力和所需的解析度。如圖 20 所示,由於峰寬與物質含量直接相關,因此樣品載量對解析度有重大影響。因此,為了達到令人滿意的解析度,施加並結合在介質上的蛋白質總量不應超過填料柱的總結合能力。

圖 20.增加樣品負載對解析度的影響。
使用梯度洗脱时,最多使用色谱柱总结合能力的 30%,以获得最佳分辨率。
如果样品量与色谱柱总容量相比较大,则样品缓冲液的组成,特别是离子强度,应与起始缓冲液的组成相同,以确保有足够的结合条件。
第3章 给出了每种介质的典型结合能力,作为总结合能力的指导。實際(動態)結合能力還受到分子大小和形狀、基質孔隙大小、流速、樣品濃度、pH 值/蛋白質電荷和離子強度等因素的影響。對於直徑或長度非常大的分子,例如蛋白質複合物>Mr 400 000、不對稱蛋白質和 DNA,結合能力會降低。這些分子無法穿透基質孔隙,使其主要與基質表面的帶電基團結合。
結合步驟和動態結合能力可透過在目標蛋白質帶有較高電荷的 pH 值下施加樣品來增加,而不是使用最佳的分離 pH 值。
樣品容量
作為一種結合技術,只要樣品的離子強度與起始緩衝液相同或一樣低,且目標蛋白在所選 pH 值下帶有足夠的電荷,IEX 與樣品容量無關。
洗脫
結合的蛋白質會透過離子強度或 pH 值的控制變化而被洗脫。根據分離的目的選擇這些變化發生的方式,使用線性或階躍洗滌:
- 線性梯度洗脫
- 高解析度分離或分析
- 以更快的速度進行最佳化梯度洗脫,同時保留所需的解析度 。
- 分步洗脫
- 更快的分離時間,減少緩衝消耗
- 分組分離
線性梯度洗脫
目的:高解析度分離或分析、篩選
使用10-20柱容量的線性漸層洗脫開始,離子強度增加至0.5 M NaCl (50%B).

圖 21.使用線性梯度洗脫的典型 IEX 分離。紫外線(蛋白質)和電導率(鹽)痕跡顯示蛋白質峰的洗脫和洗脫過程中鹽濃度的變化。
線性離子強度梯度,如圖21所示,是最常用的洗脫方式,從未知樣品開始(當盡可能多的成分結合到色譜柱並進行不同洗脫以查看總蛋白質圖譜時),應始終使用線性離子強度梯度。在低離子強度下,IEX 媒介上帶電基團的競爭最小。增加離子強度會增加競爭,減少介質與開始洗脫的結合物質之間的互動。洗脱缓冲液通常与起始缓冲液的缓冲盐和 pH 值相同,但含有额外的盐,最常见的是氯化钠。
强烈建议在方法开发过程中使用线性梯度洗脱。線性離子強度梯度很容易製備,而且由合適的色譜系統產生時重現性極高。
帶電蛋白質在介質上的保留與色譜柱的容積和其上的濃度差有關:
- 長而淺的梯度可使峰間的分離度最大,但分離時間會更長,峰寬也會更大。
- 短而陡的梯度可加快分離速度,使峰更清晰,但洗脫的峰會更接近。
- 在梯度後洗脫的峰往往比早期洗脫的峰更寬。
選擇最陡的梯度,以便在所選 pH 值下獲得可接受的解析度。
梯度斜率的影響如圖 22所示。

圖 22.梯度斜率對解析度的影響,理論與實務。
如果縮小梯度洗脫量,則可能需要按比例降低樣品載量,以保持相同的解析度。
梯度最好使用專門設計的設備來形成,例如ÄKTAdesign系統,它具有預編程的方法模板,可以自動控制提供給色谱柱的溶液的混合。具有BufferPrep功能的ÄKTAdesign系統用戶可以從一系列緩衝液配方中選擇,以恆定的pH值運行鹽梯度洗脫。
BufferPrep會自動計算和混合正確比例的儲備溶液,以便在整個運行過程中保持恆定的pH值。
精确的缓冲液制备、高效的混合以及混合器与色谱柱顶部之间尽可能短的流动路径将有助于确保准确的梯度形成。
目的:縮短分離時間,保持分辨力
對於某些分離,當使用線性梯度進行高分辨力分離的條件已經確立時,如圖 23所示,可以通過使用更複雜的洗脫剖面縮短總分離時間。在需要最高解析度的地方可以使用較淺的梯度,而在解析度滿意的區域則可以使用較陡的梯度。

圖 23.複雜的梯度剖面可以減少某些分離的總分離時間。
分步洗脫
用 5 個柱容量的起始緩衝液 + NaCl 以所選的離子強度洗脫結合蛋白。
以更高的離子強度重複進行,直到目標蛋白被洗脫為止。

圖 24.典型的 IEX 分離使用步進洗脫。紫外線 (蛋白質) 和電導 (鹽) 跡象顯示蛋白質峰的洗脫和洗脫過程中鹽濃度的變化。
如圖 24所示,階級洗脫是在離子強度不斷增加的情況下依次加入相同的緩衝液進行的。階梯洗脫在技術上很簡單,但在階梯設計和結果詮釋時必須小心,因為通過離子強度的急劇變化洗脫的物質會靠近一起洗脫,產生可能包含多種成分的假峰。由於峰值通常包含多種成分,因此峰值往往具有尖銳的前沿和明顯的尾部。如果過早引入離子強度變化,尾流可能會導致出現假峰。
目的:更快的分離時間、更少的緩衝液消耗
當使用梯度洗脫優化了 IEX 分離時,改用階梯洗脫可減少分離時使用的色譜柱總容量。這可加快分離時間,減少緩衝劑消耗,同時保持所需的純度水平。這種類型的階梯洗脫通常用於常規、大規模的分離。在大規模使用時,階梯洗脫的另一個優點是,由於在梯度分離中早期洗脫的分子不再佔用色譜柱上的結合能力,因此通常可以使用更多的樣品量。
目的:群組分離
在群組分離中,感興趣的分子被濃縮,並迅速從不需要的物質中去除。當目標蛋白質和污染物的結合和洗脫條件確定後,通常是在初步梯度洗脫分離過程中,選擇條件使目標蛋白質的結合最大化,而污染物的結合最小化。Figure 25展示了這樣一個分離的例子:使用HiTrap Q HP色譜柱分離人類血清蛋白與直接通過色譜柱的不需要的IgG部分。

圖 25.在 HiTrap Q HP 上分組分離血清蛋白。
目的:去除雜質
如果起始條件已經選擇為最大限度地結合雜質,那麼就不需要改變洗脫條件,因為目標蛋白質將會通過色譜柱。
pH洗脱
由于蛋白质的净电荷取决于 pH 值,因此也可以通过改变洗脱缓冲液的 pH 值从 IEX 培养基中洗脱样品。由於沒有鹽梯度,樣品只需以一種 pH 值保留在色譜柱上,然後透過增加或減少 pH 值來洗脫。
- 與陰離子交換器(Q、DEAE、ANX)結合的蛋白質會隨著 pH 值的降低而洗脫。
- 與陽離子交換器(SP、S、CM)結合的蛋白質會隨著 pH 值的升高而洗脫。
由於pH洗脱需要在接近蛋白質等電點的pH值下進行,而且許多蛋白質在接近其等電點時會顯示出最小溶解度,因此必須採取預防措施以避免在色譜柱上出現沉澱。
在分离过程中,一定要事先测试样品成分在pH值和盐浓度下的溶解度。
对于任何类型的pH洗脱,都必须注意缓冲液体系的选择和混合,以实现重现性。與使用線性 pH 梯度相比,漸進式 pH 洗脫更容易製作,重現性也更高。請注意,對於弱離子交換器,緩衝液可能必須滴定介質上的帶電基團,在達到新的 pH 值之前,會有一段短時間的再平衡。
線性 pH 梯度很難在恆定的離子強度下產生,因為離子強度的同步變化雖然很小,但也會發生。這些梯度無法透過簡單地將不同 pH 值的緩衝劑以線性體積比混合而獲得,因為所產生的系統的緩衝能力取決於 pH 值。
一般而言,使用色谱聚焦技术根据蛋白质的等电点分离蛋白质,可能比尝试使用 pH 梯度从 IEX 柱洗脱蛋白质提供更可靠、分辨率更高的结果。
流速
分离过程中应用的最大流速可根据分离阶段而变化。例如,在样品应用和洗脱过程中,较低的流速可使样品成分在与官能团结合或解离时有时间在孔隙中扩散和流出。圖 26 顯示流速對解析度影響的範例。
第 3 章给出了每种色谱介质的推荐流速。根據這些建議, 選擇可維持解析度並縮短分離時間的最高流速。例如,如果峰在低流速下分離良好,則增加流速,或者,增加樣品容量,以受益於更高的容量而不會明顯損失解析度。

圖 26.增加流速對解析度的影響。
流速以簡單的體積計量,例如 mL/min,但在比較不同尺寸色譜柱之間的結果或擴展時,使用線性流量:cm/hour(附錄 5)是有用的。
在高鹽洗滌和再平衡步驟中使用較高的流速可節省時間。
高流速和粘性缓冲液会增加操作压力(请记住,在 +4 °C 下运行时,缓冲液的粘性会增加)。
流量控制
精确、可重现的流量控制对于良好的分辨率和重现性至关重要。
在色谱系统中使用泵(而不是蠕动泵),以充分利用 MiniBeads、MonoBeads、SOURCE 或 Sepharose High Performance 等介质的高刚性和优异的流动特性。
始终将缓冲液泵到色谱柱上(而不是用下面的泵将缓冲液引过色谱柱)。這樣可以降低因抽吸而形成氣泡的風險。如果您已自行填料柱,請務必使用小於柱填料流速的流速進行分離,以避免在運行樣品時可能發生的壓力增加導致柱床收縮。
清洗和重新校正
用 5 柱体积的 1 M NaCl (100%B) 清洗,以洗脱任何剩余的离子结合物质。
在每次運行結束時都包含一個洗滌步驟,以去除任何仍與介質結合的分子。
使用 5-10 柱体积的起始缓冲液重新平衡,或直到洗脱液的 pH 值和电导率达到所需值。
清洗後的再平衡步驟可使色谱柱回復到應用進一步樣品前的起始條件。盡可能監測 pH 值和電導率,以檢查何時達到啟動條件。
在清洗和再校准步骤中增加流速,以节省两次运行之间的时间。
如果使用了离子洗涤剂,用 5 柱体积的蒸馏水清洗色谱柱,然后用 2 柱体积的 2 M NaCl 进行清洗。用至少 10 柱体积的起始缓冲液重新校准,直到 UV 基线、洗脱液 pH 值和/或电导率稳定为止。乙醇等有機溶劑可用於去除非離子洗滌劑。選擇有機溶劑時,請檢查介質的化學穩定性,以確定合適的濃度。
洗滌劑、變性劑和其他添加劑
任何用於離解、溶解、金屬螯合、酵素抑制等的添加劑,都應經常檢查其電荷特性。應經常檢查其在工作 pH 下的電荷特性。
样品制备期间使用的添加剂将在 IEX 期间与样品成分分离。如果發現蛋白質沉澱、洗脫晚於預期或分離不良,請在起始緩衝液和洗脫緩衝液中加入適當濃度的用於初始增溶的添加劑。
鋅離子添加劑(如甜菜鹼)可防止沉澱,並可在不干擾梯度洗脫的情況下使用高濃度添加劑。
去垢劑可用作水溶性低的蛋白質(如膜元件)的增溶劑。
去垢剂(如盐酸胍或尿素)可用于样品的初始增溶和分离过程。但是,除非變性是必需的,否則應避免使用。請注意,在用於分離的 pH 值下,胍是帶有反負離子的帶電分子,因此會以與 NaCl 相同的方式參與離子交換過程。
常用洗滌劑和變性劑的示例見表 4。
使用含有去垢劑的緩衝液開發或優化分離
- 選擇與樣品相容的去垢劑。去垢劑必須是中性、具有齊聚物或與 IEX 媒介具有相同的電荷。與介質結合的去垢劑很難去除,並可能影響蛋白質的負載能力、pH 值、傳導性和解析度。
- 確定在分離過程中可能使樣品保持在溶液中的最低濃度。
- 用去垢劑溶液徹底平衡色譜柱,使用的濃度應低於特定去垢劑的臨界膠束濃度。
- 運行空白鹽梯度,以確定去垢劑的紫外吸光度剖面,並檢測pH值的任何影響。膠束形成會導致光線散射,並在 UV 監測期間出現峰值。如果膠束形成是一個問題,請嘗試以下方法:
- 在不影響樣品溶解度的情況下,盡可能降低洗滌劑濃度
- 增加洗滌劑濃度,使梯度高於臨界膠束濃度(這會產生漸進而非
突然的紫外線增加)
;- 改變鹽梯度,使紫外線吸收的突然變化不會在運行過程中發生
- 改用高混沌鹽,如 LiClO4 或三氯乙酸鈉,這些鹽可以在不
的情況下使用較高的濃度。br> 導致膠束形成 - 使用樣品進行測試運行,找出可提供最佳溶解度和解析度的洗滌劑。
從「去垢劑運行」中獲得的單一峰值通常包含多種成分,因此應仔細分析。選擇不同的洗滌劑可能會改善分離效果。
洗滌劑濃度過高會增加緩衝液粘度,因此必須降低流速以避免色譜柱過壓。在分離過程中,通常可以降低增溶所需的洗滌劑濃度。
使用不含鹽分的最高品質洗滌劑。
在使用含有洗滌劑的緩衝液之前,請使用建議的程序徹底清洗之前使用過的色譜柱。
可降低極性的試劑
緩衝液中可加入單乙二醇、甘油和類似可降低極性的溫和試劑。避免使用高濃度 (40% w/w),因為緩衝液的黏度會增加,並可能造成色譜柱壓力過高。
金屬螯合劑:EDTA, EGTA
EDTA (乙二胺四乙酸) 和 EGTA (乙二醇-雙-(2-氨基乙基)-N,N,N',N'-四乙酸) 常常作為金屬螯合劑用於緩衝液中,可與 IEX 色譜配合使用。EDTA 和 EGTA 含有多個可與陰離子交換器互動的羧酸基團。在陰離子交換分離過程中,EDTA 和 EGTA 會在色譜柱上聚集成一條帶,並在鹽梯度過程中洗脫。這兩種分子都會吸收紫外線,並在色譜圖中顯示為峰值或背景雜訊。
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?