引言
在過去的二十年中,在開發 生物相容性材料 和 生物可降解材料 在生物醫學應用領域取得了重大進展,而後一類材料在工業應用領域也取得了重大進展。在生物醫學領域,我們的目標是開發和表徵人工材料,或者換句話說,"備件"1 用於人體,以測量、恢復和改善生理功能,並提高存活率和生活品質。一般而言,無機 (金屬、陶瓷和玻璃) 和高分子 (合成和天然) 材料已被用於人工心臟瓣膜 (高分子或碳基)、合成血管、人工臀部 (金屬或陶瓷)、醫療黏合劑、縫合劑、牙科複合材料,以及用於控制緩慢藥物輸送的聚合物等項目。開發新的生物相容性材料時,除了要考慮材料的無毒性之外,還要考慮材料的生物活性,因為這些材料會與生物環境產生互動,並隨時融入生物環境中,同時還會根據特定的"in vivo"應用,提供其他量身打造的特性。2
與此平行的"生物仿生學"領域可被描述為從大自然中抽象出好的設計",或者簡單來說,從大自然中偷竊想法"。其目的是在自然界的啟發下,將材料與人工製造的非生物裝置或程序結合,製造出非生物用途的材料。
生物相容性聚合物
生物相容性聚合物在控制藥物輸送方面的應用一直是研究活動的重點之一。它是由延長和更好地控制給藥時間的需求演變而來的。控釋裝置的目標是只需單次劑量即可將藥物維持在所需的治療範圍內。將藥物局部釋放至特定的身體區塊,可降低全身的藥物濃度,減少後續照護的需求,保留會被身體快速破壞的藥物,並增加病患的舒適度及/或改善依從性。3
控制釋放系統的方便分類是基於控制相關物質釋放的機制。最常見的機制是擴散。目前已開發出兩種擴散控制系統;第一種是儲存裝置,其中生物活性劑(藥物)形成一個核心,四周圍以惰性擴散屏障(圖 1)。這些系統包括膜、膠囊、微膠囊、脂質體和中空纖維。第二種是單片裝置,其中的活性劑分散或溶解在惰性聚合物中(圖 2)。3,4
在化學控制系統中,可使用生物可odible 或懸掛鏈實現化學控制。使用生物可侵蝕(或生物可分解)系統的理由是,生物可侵蝕裝置最終會被人體吸收,因此不需要透過手術移除。聚合物生物轉化可定義為將不溶於水的材料轉化為溶於水的材料。在可生物侵蝕的系統中,理想的藥物分佈方式與單體系統相同,均勻地分佈在聚合物中。當藥物周圍的聚合物被侵蝕時,藥物就會逸出(圖 3)。5,6 在溶劑活化控制系統中,活性劑溶解或分散在聚合物基質中,無法透過該基質擴散。7 因此,膨脹的聚合物處於橡膠狀態,允許其中所含的藥物通過膠囊劑擴散。
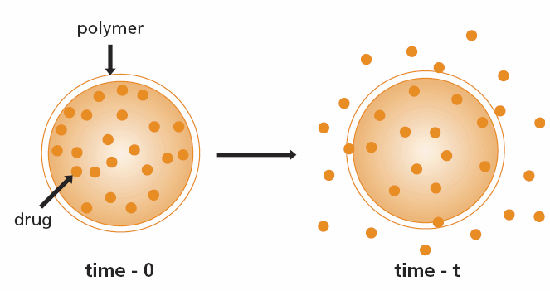
圖 1.儲存庫擴散控制給藥裝置示意圖。
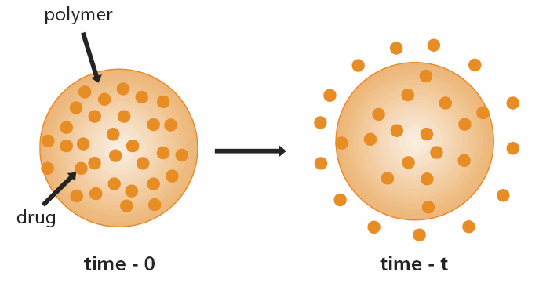
圖 2.單片(矩陣)擴散控制給藥裝置示意圖。
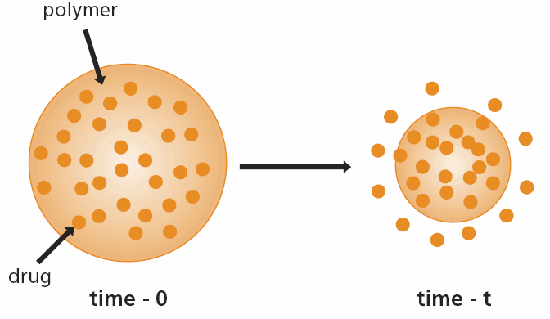
圖 3.可生物降解 (bioerodible) 藥物輸送裝置的示意圖。
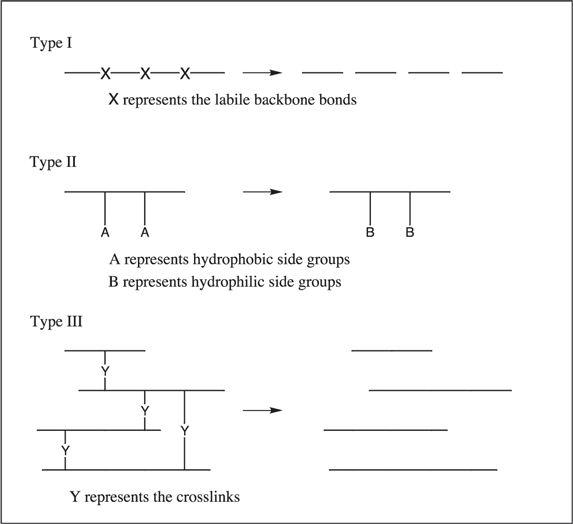
圖 4.聚合物降解類型示意圖。
具有可水解化學鍵的生物可分解聚合物正被廣泛地研究用於生物醫學、製藥、農業和包裝應用。10 為了用於醫療設備和控制藥物釋放的應用,生物可降解聚合物必須具有生物相容性,並符合其他標準,才能成為合格的生物材料--可加工、可消毒,並能因應生物條件而控制穩定性或降解。11 降解產物通常會決定聚合物的生物相容性,而不一定是聚合物本身。基於聚乳酸 (PLA)、聚乙二醇醚 (PGA)、聚己內酯 (PCL) 及其共聚物的聚酯已被廣泛用作生物材料。12,13 這些材料降解後會產生相對應的羥基酸,因此可以安全地在體內使用。
其他 生物/環境可降解聚合物 包括 PHB-PHV 類的聚(羥基烷酸酯)、其他聚(酯)和天然聚合物,特別是改性聚(糖),例如、
甲殼素是一種具有重要技術價值的生物材料。甲殼素是世界上含量僅次於纖維素的天然聚合物。在脫乙酰化後,它會產生新穎的生物材料甲殼素,在進一步水解後會產生分子量極低的寡糖(結構 1)。甲殼素具有多種有用的特性。具體來說,它是一種生物相容性、抗菌且環保的聚電解質,因此可應用於多種領域14 包括水處理、層析、化妝品添加劑、抗菌紡織品處理、15 等。sup>15 用於紡織品的新型纖維、相紙、可生物降解的薄膜、16 生物醫學裝置,以及用於藥物輸送中控制釋放的微膠囊植入物。17-19
。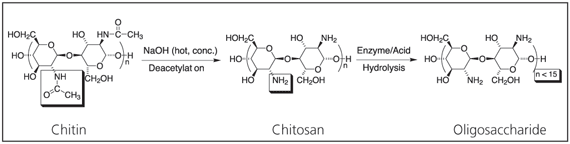
方案 1.甲殼素脫乙酰化形成甲殼素,水解形成寡糖。
Poly(ethylene glycol)s 1950 年首次出現在美國藥典中。
聚(環氧乙烷)(PEO)和聚(對苯二甲酸丁二醇酯)(PBT)的多嵌段共聚物也正在開發中,可用作假肢裝置和人造皮膚,以及組織工程的支架。20 這些材料會受到水解(通過酯鍵)和氧化(通過醚鍵)的影響。降解率受 PEO 分子重量和含量的影響。
一種廣泛使用的不可降解聚合物是 乙烯-醋酸乙烯共聚物。這種共聚物具有出色的生物相容性、物理穩定性、生物惰性和加工性。在藥物輸送應用中,這些共聚物通常含有 30-50 重量百分比的醋酸乙烯酯。乙烯-醋酸乙烯共聚物膜是藥物擴散的限速障礙。在第二類可降解聚合物中,疏水取代基轉換為親水側基是降解過程的第一步。一組研究人員已經解決了製造開孔、可生物降解聚合物支架用於細胞播種或其他組織工程應用的問題。21 選用的材料是酪氨酸衍生的聚碳酸酯聚(DTE-co-DT carbonate),其中經由氨基酸酪氨酸的懸附基為乙酯(DTE)或游離羧酸鹽(DT)。透過改變 DTE 與 DT 的比例,可操縱材料的疏水/親水平衡以及 體內降解率。研究顯示,隨著 DT 含量的增加,孔隙尺寸會減少,聚合物會變得更親水、更陰離子,細胞也會更容易附著。
可滲透水的聚合物網路 一端可發揮水凝膠的功能,另一端則可發揮超級吸收劑的功能。水凝膠的特徵在於其化學結構對水溶液具有明顯的親和力,在水溶液中會膨脹而非溶解。此類聚合物網路的吸水性從溫和吸水(通常在其結構中保留 30 重量百分比的水)到超級吸水(保留數倍於其重量的水性流體)不等。Several synthetic strategies22 have been proposed to prepare absorbent polymers including:
- 經過共價交聯的聚電解質23
- 由親水性和疏水性成分組成的共組聚合物("有效"交聯")22"。quot;有效"的氫鍵交聯)24-26
- 物理上互相穿透的聚合物網路可產生高機械強度的吸水聚合物。27
很明顯,這些策略並不是互相排斥的,我們的工作重點在於量身打造複合凝膠,而複合凝膠在各種刺激(包括溫度、pH 值、離子強度、溶劑、濃度、壓力、應力、光強度、電場或磁場的變化)下的結合,主要取決於聚合物與聚合物之間以及聚合物與溶劑之間互動的平衡。28,29 這些刺激反應聚合物,也就是所謂的智慧型凝膠,仍是各領域應用的廣泛研究主題。這些應用範圍包括生物醫學(控制藥物釋放,眼部裝置和生物仿生學)、30-32 農業(土壤添加劑以節約用水,植物根部包衣以增加水的可用性,以及種子包衣以增加發芽率)和個人護理(尿布和成人衛生產品)、23,33 到工業(增稠劑、膠凝劑、電纜包裝、特殊包裝、天然橡膠的減粘劑,以及精煤脫水)。34-37
吸收性聚合物可能來自合成(石化)產品,其中形態和孔隙率的影響會影響吸收性。38 Sigma-Aldrich也提供天然(澱粉等)和半合成(纖維素醚等)聚合物的廣泛選擇,可用於合成多組分水凝膠。39 為了協助您設計特定應用的水凝膠,Sigma-Aldrich 提供超過 1,500 種單體 和多種交聯劑 。
交聯劑
交聯是指在分子鏈之間形成化學鏈結,以形成連接分子的三維網絡。使用元素硫對橡膠進行硫化就是交聯的一個例子,可將生橡膠從弱塑膠轉變為高彈性的彈性體。共價交聯的策略也用於其他幾種具有商業和科學價值的技術中,以控制和增強所產生的聚合物系統或介面的特性,例如熱固性塑料和塗料。40-42
交聯已被運用在離子交換樹脂43 和刺激反應式水凝胶44 的合成中,這些水凝胶是由含有極性基團的聚合物分子製成的。作為聚電解質,水凝胶本身就是水溶性的。為了使水凝膠不溶於水,在製造過程中或在起始單體聚合之後的第二個反應中,會對水凝膠進行化學交聯。以交聯密度來量化的交聯程度,加上分子結構的細節,對交聯系統的膨脹特性有深遠的影響。在 圖 4 中, 在特定生物條件下交聯的損失會導致 III 型聚合物降解。
生物相容性無機材料
陶瓷可能會讓人聯想到茶壺和瓷磚地板等物件。陶瓷還有許多其他的技術應用,而且越來越多地應用在生物醫學領域。生物陶瓷具有關節或組織替代物的結構功能,可用作塗層以改善金屬植入物的生物相容性,並可作為可吸收晶格,提供臨時結構和框架,當人體重建組織時,可溶解和更換這些結構和框架。陶瓷的熱穩定性和化學穩定性、高強度、耐磨性和耐用性都使陶瓷成為外科植入物的理想候選材料。
用於外科植入物和醫療裝置的材料必須首先做到無毒。
用於外科植入物和醫療裝置的材料首先必須是無毒的,而生物陶瓷則能滿足這一要求,此外,生物陶瓷還具有生物惰性(即不與生物系統互動)、生物活性(即能與周圍組織進行界面互動的耐用材料)、生物可降解性、可溶性或可吸收性(最終被組織取代或融入組織中)。糖分和蛋白質可與某些陶瓷結合。45-47
由於其強度、彈性和生物相容性,鈦合金常被用於關節和骨植入物。鉻和鈷合金以及不銹鋼也基於類似原因被用於骨植入物,儘管較不常用。
形狀記憶合金在血管成形術等程序中具有生物醫學應用,它們可以防止血管再次阻塞。這些超微粒材料利用了鈦的生物相容性,但其強度約為傳統鈦植入物的 10 倍。49
醫療應用的完美材料不僅要具有生物相容性,還要具有與被取代或修復的組織或其他生物系統相似的物理特性。50
陶瓷雖然具有良好的耐化學性和耐腐蝕性,但卻是出了名的脆。因此,研究人員一直在尋找方法,將理想的陶瓷與其他材料結合,以量身打造強度和彈性等特性,滿足系統需求。複合材料、功能梯度材料和塗層已被研究來優化材料的選擇。陶瓷塗層、生物相容性金屬似乎在金屬的強度與彈性,以及陶瓷融入生物系統的能力之間,提供了極佳的折衷方案。
許多研究都致力於生物系統與羥基磷灰石的界面反應,羥基磷灰石是一種化學結構與骨頭的堅硬結構非常相似的陶瓷。羥基磷灰石被用作金屬外科植入物(通常由鈦及其合金或不鏽鋼製成)的塗層,最近的研究則探討了它以複合物形式使用的可能性,也就是結合聚合物與陶瓷或金屬/陶瓷組合的材料。對於磷灰石的塗層應用和原位合成方法,以及對陶瓷特性和微觀結構的影響,已經進行了大量的研究。
目前有許多形式和成分的陶瓷正在使用或考慮中,還有更多的陶瓷正在開發中。自從幾千年前發現穩定的 SiO2-Na2O-CaO 陶瓷配方以來,人類使用的大部分矽酸鹽陶瓷的 SiO2 含量都在 65 wt % 或以上。這些 SiO2-Na2O-CaO 陶瓷更常被稱為玻璃。雖然這些重量百分比為 65% 的矽玻璃具有極高的生物惰性,但它們幾乎不具備其他可取的特質。它們很脆弱,而且很容易碎裂。第一種生物活性玻璃含有 20-25 wt. % Na2O 和 20-25 wt. % CaO,只有 45-55 wt. % SiO2。不幸的是,這種新型玻璃仍然非常脆弱易碎。在 SiO2-Na2O-CaO 矩陣中加入 P2O5 使玻璃具有極高的生物活性。
生物活性玻璃和可加工玻璃陶瓷有許多商品名稱。一些專利陶瓷,例如「Ceravital」和「Bioglass 45S5」,具有極高的生物活性,在植入後一小時內就會形成深達近 500 nm 的 HCA 層(骨[內]生長的前體)。此外,據稱已觀察到「Bioglass 45S5」表面的軟組織生長。氧化鋁和氧化鋯是用於義肢裝置的生物惰性陶瓷。多孔陶瓷如磷酸鈣基材料則用於填充骨缺損。某些陶瓷材料的孔隙率和溶解度控制能力提供了用作藥物傳輸系統的可能性。例如,玻璃微球已被用作放射性治療劑的傳輸系統。
材料選擇還必須考慮形成具有嚴格尺寸公差的複雜形狀的要求。在人體內使用的裝置必須能夠承受生物環境的腐蝕,並在不造成過度磨損(且不會對周遭組織造成損害)的情況下經得起長年累月的使用。在插入之前,它們在儲存期間應保持不變,並必須可以無損地進行消毒。
總而言之,新型無機和高分子生物材料的發現,以及傳統材料的改良,正為這個領域帶來前所未有的興奮,因為材料設計師正日益面對醫學科學的許多基本挑戰。隨著生物材料科學本身的演進,過去幾年在基因組學與蛋白質組學、各種高通量細胞處理技術、超分子與包覆化學,以及資訊科技與生物資訊學等領域的驚人進展,將可為新材料的探索提供強大的分析工具,以及無限能量與複雜性的洞察力。
超分子化學
超分子化學超分子化學是另一個引人入勝、前景無限的新領域,其關注的是在模仿自然界中的奈米級系統或機制 (生物仿生學) 的大分子架構基礎上,開發生物應用的分子組合。基於超分子化學的新穎合成方法已被用來創造支化或接枝、環狀、交聯、星形和樹枝狀聚合物結構。Sigma-Aldrich 提供的樹枝狀聚合物完整清單,請參閱奈米材料部分。
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?為便利客戶閱讀,此頁面中文以機器翻譯完成。雖然我們已盡力確保機器翻譯的準確性,但機器翻譯並非完美。如果您對機器翻譯的內容不滿意,請參考英文版本。