dsDNA 結合染料
雙鏈 DNA (dsDNA) 結合染料的功能是作為夾層和/或小溝結合劑,與 dsDNA 結合時發出可檢測的螢光,但在溶液中游离時背景非常低。因此,螢光信號強度會隨著存在的擴增子數量成比例增加。雙鏈 DNA 結合染料很受歡迎,因為它們是一種低成本的檢測選擇,而且不需要額外的設計考量。
SYBR® Green I 染料
這種染料是最流行的 dsDNA 結合染料,在分子生物學中的使用歷史悠久。在溶液中游离时,只有单链 DNA (ssDNA) 存在,SYBR Green I 染料发出低强度信号(图 5.1,表 5.1)。隨著 PCR 的進行和 dsDNA 量的增加,更多的染料與擴增子結合,因此信號強度增加(請參閱以下網頁的動畫 sigma.com/sybr-animation)。然而,由於染料會不加選擇地結合到所有擴增的產物上,因此引物二聚體或引物的非特異結合等所產生的假象也會造成整體的螢光。這會造成難以獲得精確的定量,尤其是在低模板濃度時。然而,PCR 後的熔融曲線分析可以幫助確定反應的特異性1 (圖 5.2)。

圖 5.1.隨著反應的進行,SYBR Green I 染料會在未結合(變性)和結合(退火到延伸)兩種狀態之間循環,信號強度會隨著擴增子數量的增加而增加。
| 激發最大值(nM)a | 放射最大值(nM) | |
|---|---|---|
| 報告染料 | ||
| SYBR Green 1 | 497 | 520 |
a 與 dsDNA 複合時
。
圖 5.2.dsDNA結合染料可逆性結合,因此當反應溫度升高至熔融溫度 (Tm) 以上時,螢光強度會降低。結合對照,此類分析可檢測出熔融溫度與特定產品不同的非特異性產品。
探針
在 qPCR 的所有應用中,擴增反應由特定的正向和反向引物驅動。然而,與依賴使用 dsDNA 結合染料進行檢測不同的是,探針檢測系統不包括游離染料,而是與報告染料和/或淬滅分子結合的第三個寡核苷酸(有時還包括第四個寡核苷酸)。
雙標示探針
雙標示探針(也稱為水解探針或 TaqMan® 探針)用於 5' 核酸酶檢測2,3,這是最流行的探針檢測化學方法(圖 5.3;也可參閱以下網頁的動畫: sigma.com/probe-animation)。雙標示探針是一種單鏈寡核苷酸,標有報告染料和淬滅分子。報告染料位於 5「 端,而淬火劑位於 3」 端。淬滅劑吸收報告者的自然螢光發射,通常是透過福斯特型能量轉移,也就是通常所說的螢光共振能量轉移 (FRET)。前向引物擴增後,Taq DNA 聚合酶會遇到探針。Taq DNA 聚合酶固有的 5「 外切酶活性會將 5」 報告者與 3' 淬滅劑分離(表 5.2,圖 5.3),提供與擴增子產量成正比的螢光信號。
水解探針檢測對低拷貝數目標的定量具有特異性和精確性。通過在探針中加入修飾的核苷酸,如 鎖定核酸(如下所述),可以進一步提高特異性。 鎖定核酸修飾的探針對於區分單核苷酸多態性(SNP)或其他類似序列特別有用。雙標示探針需要精心設計(PCR/qPCR/dPCR Assay Design),而且通常比 dsDNA 結合染料更昂貴。此外,雖然非特異性的產物擴增可能仍未被檢測到,但副反應可能會導致整體反應的效率降低,因此含有探針的檢測仍可從最佳化中獲益(樣品純化與品質評估)。

圖 5.3.雙標示探針的機制。Taq DNA 聚合酶會延伸與探針位於同一條鏈上的引物,直到達到探針位置。固有的外切酶活性會將探針從 5「 水解到 3」,這會釋放報告染料到溶液中,從而導致螢光增加。測得的螢光信號與目標 DNA 的數量成正比。
| Name | Excitation 最大值 (nm) | 發射 最大值 (nm) | 相容 Quencher |
|---|---|---|---|
| 報告染料 | |||
| 6-FAM™ | 494 | 515< | BHQ®-1, TAMRA |
| JOE™ | 520 | 548< | BHQ-1,TAMRA |
| TET™ | 521 | 536 | BHQ-1, TAMRA |
| Cal Fluor® Gold 540a | 522 | 541 | BHQ-1 |
| HEX™b | 535 | 555 | BHQ-1, TAMRA |
| Cal Fluor Orange 560b | 540< | 561 | BHQ-1 |
| TAMRA™ | 555 | 576< | BHQ-2 |
| Cyanine 3 | 550 | 570 | BHQ-2< |
| Quasar® 570c | 548 | 566< | BHQ-2 |
| Cal Fluor Red 590d | 565 | 588< | BHQ-2 |
| ROX™ | 573 | 602 | BHQ-2< |
| TxRd (Sulforhodamine 101-X) | 583 | 603 | BHQ-2 |
| 顏料 5 | 651 | 674 | BHQ-3 |
| Quasar 670e | 647 | 667 | BHQ-3 |
| 青色5。5 | 675 | 694 | BHQ-3 |
| JOE/TET alternative b VIC® alternative | c Cyanine 3替代品 d TAMRA替代品 | e 燐寧 5 替代品 | |
大多數實時 PCR 熱循環儀都有多個檢測通道,可以靈活選擇探針標記。關鍵是要選擇與儀器檢測通道相容的報告染料,並確保正確的過濾器和校準到位。當進行多路複用時,報告器組合必須盡可能彼此不同,以減少光交雜。典型的報告器包括FAM、HEX、TxRd (Sulforhodamine 101-X) 和 Cyanine 5。在相同條件下,通常會觀察到不同報告器的發射強度不同。因此,建議您獨立分析每個報告器組合的資料(針對探針發射使用不同的閾值設定)。
分子信標
分子信標(也稱為雜交探針)是單鏈探針,在每個末端4(圖 5.4)由互補莖序列(4-6 個核苷酸)保持髮夾環構象(20-25 個核苷酸)。髮夾環與模板互補,當探針在溶液中游离時,氫鍵莖序列允許 3「 淬滅器抑制 5」 報告器的螢光(表 5.3)。
圖 5.4.分子信標的機制。分子信標與特定的目標序列進行雜交,導致髮夾環結構打開,將 5「 報告器與 3」 釋放器分離。由於淬滅劑不再接近報告器,螢光便會發射。與雙標籤探針不同,分子信標的檢測機制不依賴於反應過程中的降解。測得的螢光信號與目標 DNA 的數量成正比。
| Name | Excitation Maximum (nm) | Emission Maximum (nm) | Compatible Quencher | |
|---|---|---|---|---|
| Name | Excitation Maximum (nm) | Emission Maximum (nm) | 相容 淬火器 | |
| 494 | 515 | BHQ®-1, DABYCL | ||
| 螢光素 | 495 | 520 | BHQ-1, DABYCL | |
| JOE™ | 520 | 548 | BHQ-1, DABYCL | |
| JOE™ | TET™ | 521 | 536 | BHQ-1, DABYCL< |
| HEX™ | 535 | 555 | BHQ-1, DABYCL | |
| Cyanine 3 | 550 | 570 | 570 | BHQ-2, DABYCL |
| ROX? | 573 | 602 | BHQ-2, DABYCL | |
| ROX™。 | ||||
| TxRd (Sulforhodamine 101-X) | 583 | 603 | BHQ-2, DABYCL | |
| Cyanine 5 | 651< | 674 | BHQ-3,DABYCL | |
| 顏料 5.5 | 675 | 694 | BHQ-3, DABYCL |
LightCycler® 探針
LightCycler® 探針LightCycler 探針或 FRET 系統(也稱為雙雜交探針)由一對單鏈螢光標記寡核苷酸5,6 (圖 5.5).寡核苷酸探針 1 在 3「 端用供體螢光染料標記,寡核苷酸探針 2 在 5」 端用幾種可用的受體螢光染料之一標記(表 5.4)。Oligo Probe 2 的游離 3' 羥基必須用磷酸基封堵,以防止 DNA 聚合酶延伸。

圖 5.5.LightCycler FRET 探針的機制。在退火步驟中,引物和兩種探針都會與其特定的目標區域進行雜交,使供體染劑與受體染劑接近(探針通常相隔 1 到 5 個核苷酸)。當供體受來自 realtime PCR 儀器的光線激發時,能量會透過 FRET 從供體轉移到受體。受體探針上染料的發射波長會被偵測到。螢光信號的增加與目標 DNA 的數量成正比。
| Name | 激發 | 發射 最大值(nm) 最大值 (nm) | 發射 最大值 (nm) |
|---|---|---|---|
| Oligo 探針 1:供體螢光團 | |||
| 3「 供體螢光團 (螢光素) | 495 | ||
| 3」 供體螢光團 (螢光素)td>495 | 520 | ||
| Oligo Probe 2:受體螢光團/報告染料 | |||
| 5' 受體螢光團 (LC Red 610, 640, 670, and 705)< | N/A | 610, 640, 670, 和 705 | |
Scorpions® 探針
Scorpions® 探針有兩種形式:單探針和雙探針。單探針由一個莖環結構組成,類似於分子信標,但是它連接到正向引物上,在兩個寡聚物部分之間有一個PCR封鎖器7 (封鎖器阻止Taq DNA聚合酶延伸引物(圖5.6A,表5.5)。
雙探針結構是一個雙重鏈,其中一條鏈上有5「報告鏈、探針序列、PCR封鎖劑和正向引物,另一條鏈上有3」淬滅鏈;淬滅鏈與報告鏈雙重(圖5.6B)。

圖 5.6.Scorpions® 探針的機制。單探針 A) 的所有探針元件都在一條鏈上,而雙探針 B) 的探針元件則在兩條鏈上。兩種格式的 Scorpions® 探針都包含正向 PCR 引物。前向引物會延伸成為新形成擴增子的一部分。在退火/延伸過程中,Scorpions® 中的探針序列與模板雜交,將報告物與淬滅劑分離,從而產生螢光信號。由於 Scorpions® 的尾部和擴增子是同一條鏈的一部分,檢測互動是分子內的,因此比其他探針檢測系統更快速。模板通常選擇在 Scorpions® 引物 3' 端 5 到 50 個基本位元之間。單探針和雙探針 Scorpions® 都需要單獨的反向引物。
| Name | 激發 最大值 (nm) | Emission Maximum (nm) | Compatible Quencher |
|---|---|---|---|
| Uni-Probe and Bi-Probe:報告染料 | |||
| 6-FAM™ | 494 | 515 | BHQ®-1, DABYCL dT |
| JOE™ | 520 | 548 | BHQ-1, DABYCL dT |
| TET™ | 521 | 536 | BHQ-1, DABYCL dT |
| HEX™ | 535 | 555 | BHQ-1, DABYCL dT |
| TAMRA™ | 555 | 576 | BHQ-2, DABYCL dT |
| 氰基 3 | 550 | 570< | BHQ-2、DABYCL dT |
| ROX™ | 573 | 602 | BHQ-2、DABYCL dT< |
| TxRd (Sulforhodamine 101-X) | 583 | 603 | BHQ-2, DABYCL dT |
| 顏料 5 | 651 | 674 | BHQ-3, DABYCL dT |
| 顏料 5.5 | 675 | 694 | BHQ-3, DABYCL dT |
淬火劑
大多數探針偵測系統都需要淬火劑分子。原始探針結構中使用的一些是受體螢光染料,例如 TAMRA,它與 FAM 搭配使用效果很好,但不適用於其他染料。作為報告染料本身,TAMRA 會產生螢光,因此會導致信噪比較差。因此,Biosearch Technologies 開發了發熱而非發光的暗色淬火劑,例如 Black Hole Quencher® (BHQ®)。
Onyx Quencher™ (OQ™) 是 Sigma-Aldrich 專利的暗色淬火劑。提供四種衍生版本(OQA、OQB、OQC 和 OQD)。如 表 5.6所示,四種 Onyx Quenchers 與多種流行的報告染料相容。
在 圖 5.7 Show amplification of an artificial template that was derived from a synthetic oligo for the optimization of a Schistosoma mansoni target assay8.檢測是使用 FAM 標記的探針與可比較的暗色淬火劑 CDQ (A) 或 OQA (B)。從這些數據可以看出,CDQ 和 OQA 的性能相當,對於來自相同濃度模板的分析數據,具有相似的背景螢光和相似的 Cq 值。
總之,OQ 的性能與 CDQ 相當,重要的是,OQ 可免授權、免限制、免版稅,適用於任何應用。這使得 Onyx Quencher 成為開發包含 qPCR 探針的分子診斷商業試劑盒和試劑的絕佳且具成本效益的選擇。
| 名稱 | 相容淬火劑 |
|---|---|
| 報告染料 | |
| OQA | |
| TAMRA, 鈷 3 | OQB |
| ROX, TxRd (Sulforhodamine 101-X) | OQC |
| Cyanine 5, Cyanine 5.5 | OQD |
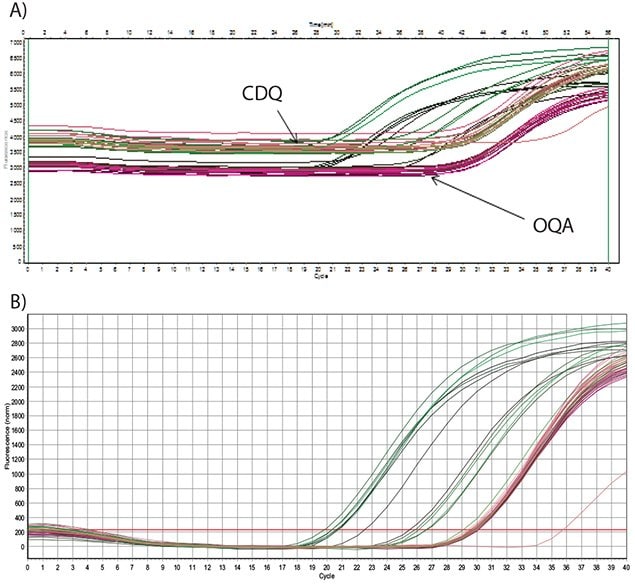
圖 5.7.使用 250 nM 引物擴增人工寡核苷酸稀釋液,並以 200 nM 的雙標示探針檢測擴增子。A) 探针用 FAM 标记,并用 CDQ 或 OQA(如所示)淬灭,原始荧光数据如图所示。B) 探針用 FAM 標記後,用 CDQ 或 OQA 淬滅,並顯示基線校正後的數據。兩種探針的表現並無顯著差異。
核酸類似物
可以使用許多修飾來生產具有改變生化特性的寡核苷酸。這些修飾通常會賦予較高的 Tm 而這些修飾可被操控以提供更佳的特異性。這有助於在具有挑戰性的序列區域或需要單一寡核苷酸檢測多種序列(例如:病毒的所有血清型)時進行檢測設計、
鎖定核酸
鎖定核酸是一種 RNA 類似基 (圖 5.8),當加入探針9時可提高靈敏度和特異性。含有鎖定核酸碱基的探針具有更高的熱穩定性,因此與模板的雜交更強。每個鎖定的核酸碱基可以使探針的Tm 增加8 °C10,這使得鎖定核酸成為SNP鑒別分析中的強大工具11 (與沒有鎖定核酸相比,單個碱基錯配對雙聯體形成的不穩定性影響更大)、多工(允許更簡單的Tm 優化)和有問題的目標序列(鎖定核酸探針可以更短,這使得它們可以圍繞問題進行設計,例如富含 AT 或 GC 的區域、重複序列或具有顯著次級結構的序列)。PCR Primers containing Locked Nucleic Acid have also been found to beneficial in applications such as SNP genotyping12.
Locked Nucleic Acid also provides protection against nuclease digestion making it suitable for in vivo use13.

圖 5.8.鎖定核酸與 DNA 核苷酸結構的比較。鎖定核酸與 DNA 的不同之處在於鎖定核酸含有核糖,其 2「 氧和 4」 碳之間有亞甲基橋,可將核糖「鎖定」在 3「 內側構象,而 DNA 則含有 2」- 脱氧核糖,沒有亞甲基橋。
| Application | SYBR Green I | 雙- 標記 探針 | 分子 信標 | LightCycler 探針 | Scorpions® 探針 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 質譜篩選 | XX | ||||||||||
| 微阵列验证 | XX | X | |||||||||
| 多個靶基因/ 少數樣本 | X | X | |||||||||
| 多個目標基因/ | |||||||||||
| SNP 檢測 | X | X | XX | X | X | XX< | |||||
| 病原偵測 | X | X | X | X | X | XX< | |||||
| 多工處理 | XX | XX | X | XX< | |||||||
| 病毒載量 定量 | X | X | X< | XX | |||||||
| 基因表達 分析 | X | XX | XX< | XX | XX | ||||||
| 基因複製 判定 | X | X | X | X | X | X | XX | ||||
| 終點 基因分型 | < | XX | XX | ||||||||
| 體外定量分析 | XX |
空白表示不推薦使用該檢測方法; X = 性能良好; XX = 性能更佳。
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?為便利客戶閱讀,此頁面中文以機器翻譯完成。雖然我們已盡力確保機器翻譯的準確性,但機器翻譯並非完美。如果您對機器翻譯的內容不滿意,請參考英文版本。