简介
作为我们不对称催化产品组合的一部分,我们很自豪地以(R)和(S)对映体形式提供异硫脲有机催化剂均苯并四咪唑(HBTM)。这些化合物已广泛应用于低催化剂负载量的各种官能团的对映选择性转化和动力学拆分。
代表性转化
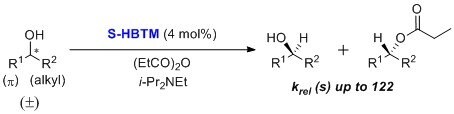
动力学拆分
S-HBTM最初是由Birman及其同事开发作为酶促条件的一种替代而用于动力学拆分仲醇。1 已报道了最多有122种选择性因子。HBTM催化剂已在各种温度范围内与多种有机溶剂一起被用于烯丙基、炔丙基和苄基仲醇的动力学拆分。反应通常在数小时内完成。据报道,在较低温度(0至55 °C)下的甲苯、氯仿或叔戊醇中可达到最佳条件。1,2
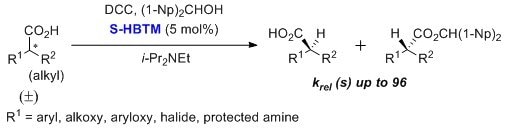
HBTM可用于α-芳基链烷酸、α-芳氧基-链烷酸、α-烷氧基-链烷酸、α-卤代链烷酸和受保护的α-氨基酸的动力学拆分。3,4 已报道了最多有96种选择性因子。该转化通常是在低温下利用甲苯作为溶剂进行24小时反应完成的。
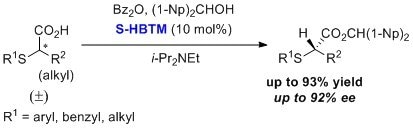
已报道了利用HBTM对对映体富集的α-硫代链烷酸的形成进行了动态动力学拆分。4,5 该过程可在广泛的底物范围内发生,并且具有高产率和高对映体纯度。
对映选择性转化
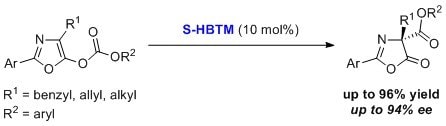
HBTM已被用于恶唑基碳酸酯的不对称羧基转移反应。6 该过程以二氯甲烷作为溶剂,在低温下进行16小时,底物普适性较好,能以较高的产率和对映选择性得到相应的产物。
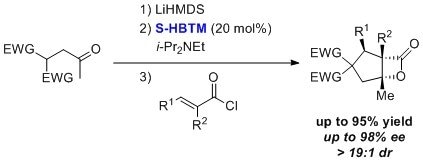
有研究表明HBTM可用于不对称亲核体催化迈克尔-醛醇-β-内酰胺化(NCMAL)的串联反应。7 该过程是在四氢呋喃/二氯甲烷中进行≤24小时发生的,从而得到具有高非对映异构体比率、高产率和高对映纯度的产物。
绝对构型的测定
HBTM是被选择用于竞争对映选择性转化(CEC)方法的催化剂,该方法可用于分配对映体富集的立体中心的绝对构型。利用HBTM的CEC方法已被报道用于仲醇,其中反应的转化率是通过1H NMR8和TLC进行测量的。9 TLC分析也已被列入为本科实验室实验。10 该过程是在室温下进行的,需经历30分钟至数小时不等。
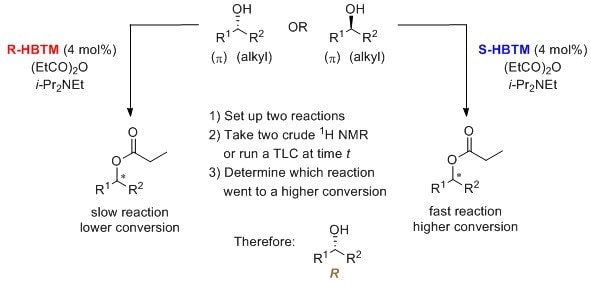
以下助记符可用于识别使用R-HBTM和S-HBTM催化剂的仲醇的绝对构型。8-10
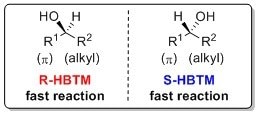
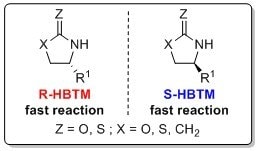
利用HBTM的CEC方法已被报道用于确定恶唑烷酮、内酰胺和硫内酰胺的绝对构型。11 该过程通常是在室温或50 °C条件下进行数小时后完成的。以下助记符可用于识别这些使用R-HBTM和S-HBTM催化剂的体系的绝对构型。
更多研究
HBTM的亲核性和Lewis碱度已通过来自利用苯甲醛离子的一系列实验的速率和平衡常数而进行了研究。12 此外,还对HBTM催化的仲醇酯化反应进行了详细的动力学分析,为该转化的催化循环提供了见解。13
特别感谢Alex Wagner先生和Scott Rychnovsky教授贡献了此篇技术关注。
参考文献
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?