BINOL及其衍生物是不對稱合成中使用最廣泛的配體類別之一;可應用於各種反應,包括:Diels-Alder反應、羰基加成和還原反應、Michael加成反應以及許多其他反應:Diels-Alder、羰基加成和還原、邁克爾加成以及許多其他反應。在 BINOL 平台取得巨大成功的同時,其他 C2 不對稱的二元醇配體也吸引了相當多的關注。其中包括 Wulff 及其合作者開發的拱頂雙芳基配體。拱頂 3,3「-biphenanthrol (VAPOL) 和拱頂 2,2」-binaphthol (VANOL) 已被證明是催化不對稱 Diels-Alder、亞胺醛多爾和唑烷化反應 (Figure 1)1的優秀配體。 最近,VAPOL 的磷酸衍生物被證實可有效地用作手性勃氏酸催化劑。在本文所說明的許多例子中,與使用 BINOL 配體的相同反應相比,拱頂雙芳烷會得到更高的產率和更高的誘導。
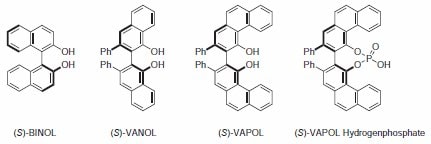
圖 1.
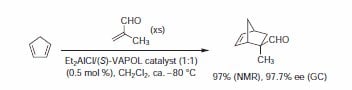
方案 1.
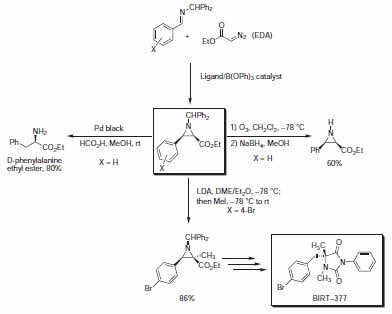
方案 2.
抗菌劑(-)-氯黴素的快速合成利用了不對稱的齊烷化反應,然後利用二氯乙酸使齊烷親核開環,隨後酰基遷移(方案 3, 表 2)。與 BINOL 衍生的催化劑相比,VANOL 和 VAPOL 均具有更高的產率和立體選擇性。
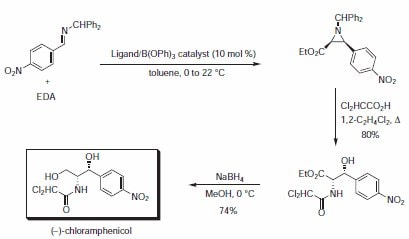
方案 3.

方案 4.
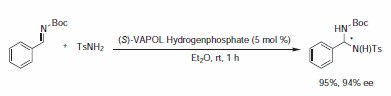
方案 5.
材料
Loading
參考資料
1.
Bao J, Wulff WD, Dominy JB, Fumo MJ, Grant EB, Rob AC, Whitcomb MC, Yeung S, Ostrander RL, Rheingold AL. 1996. Synthesis, Resolution, and Determination of Absolute Configuration of a Vaulted 2,2?-Binaphthol and a Vaulted 3,3?-Biphenanthrol (VAPOL). J. Am. Chem. Soc.. 118(14):3392-3405. https://doi.org/10.1021/ja952018t
2.
(a) Bao J, Wulff WD, Rheingold AL. 1993. Vaulted biaryls as chiral ligands for asymmetric catalytic Diels-Alder reactions. J. Am. Chem. Soc.. 115(9):3814-3815. https://doi.org/10.1021/ja00062a073
2.
(b) J B, W. D W. 1995. Angew. Chem., Int. Ed. 2000, 39, 4518. Tetrahedron Lett. .36, 3321.
2.
(c) D. P. et al H. 1997. J. Am. Chem. Soc. 119, 10551.
3.
(a) J. C A, W. D W. 1991. J. Am. Chem. Soc. .121, 5099.
3.
(b) J. C A, W. D W. 2000. Angew. Chem., Int. Ed. 2000, 39, 4518.
3.
(c) A. P. et al. P. 2005. Org. Lett. 2005, 7, 2201.. Org. Lett 7, 2201.
4.
S. et al. X. 2001. Angew. Chem., Int. Ed. .40, 2271. https://doi.org/10.1002/1521-3757(20010618)113:12<2331::AID-ANGE2331>3.0.CO;2-P
5.
Rowland GB, Zhang H, Rowland EB, Chennamadhavuni S, Wang Y, Antilla JC. 2005. Brønsted Acid-Catalyzed Imine Amidation. J. Am. Chem. Soc.. 127(45):15696-15697. https://doi.org/10.1021/ja0533085
登入以繼續
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?