Modyfikacje peptydów: N-końcowe, wewnętrzne i C-końcowe
N-końcowe, wewnętrzne i C-końcowe modyfikacje peptydów są przydatne w różnych zastosowaniach, takich jak Western blotting, badania interakcji białko-białko i testy oparte na fluorescencji. Skorzystaj z poniższej tabeli, aby uzyskać listę różnych zastosowań i uzyskać więcej informacji, w tym struktury i odpowiednie odniesienia.
Aby poprosić o wycenę niestandardowych peptydów lub o pomoc w zaprojektowaniu niestandardowej biblioteki peptydów PEPscreen® skorzystaj z poniższego łącza.

Referencje

Referencje
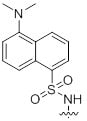
Referencje

Referencje

Referencje

Referencje

Referencje
Referencje
2.2 Karbamidometylacja cysteiny (CAM)
Karbamidometylacja (CAM) jest celową potranslacyjną modyfikacją wprowadzaną do reszt cysteiny poprzez reakcję z jodoacetamidem. Peptydy z tą modyfikacją są głównie wykorzystywane w peptydowym odcisku palca (Peptide Mass Fingerprinting) do identyfikacji i charakterystyki białek1. W innych testach proces ten jest wykorzystywany do blokowania utleniania cysteiny2.

Referencje
2.Aminokwasy znakowane izotopem 3
Peptydy AQUA to syntetyczne peptydy z aminokwasami wzbogaconymi w 18O, 13C, i/lub 14N. Są one podobne do swoich natywnych peptydów pod względem właściwości chemicznych, fizycznych, a także ich aktywności biologicznej1. Główne zastosowania tych peptydów to badanie interakcji białkowych, białek, modyfikacji po translacji, takich jak ubikwitynacja i fosforylacja2-5.
Referencje
2.4 Fosforylacja
Fosforylacja może być przeprowadzana na resztach Tyr, Ser i Thr jako modyfikacja potranslacyjna (PTM) na peptydach. Fosforylowane peptydy mają zastosowanie w wielu procesach komórkowych, takich jak ekspresja genów, interakcje białko-białko i transdukcja sygnału u roślin i zwierząt1,2.

Referencje
2.5 Spacers
Spacery są używane do tworzenia odległości między peptydem a ładunkiem w celu zmniejszenia przeszkód sterycznych w miejscach wiązania peptydu. W tym przypadku ładunkiem może być lek, barwnik, znacznik.
2.5.1 PEGylacja
Przyłączenie poli (glikolu etylenowego) do peptydu nazywane jest PEGylacją. Krótki dwufunkcyjny PEG (poli (glikol etylenowy)) może być stosowany jako przekładka w biokoniugacji peptydów z innymi cząsteczkami. Biokoniugacja PEG została również wykorzystana do poprawy stabilności proteolitycznej, biodystrybucji i rozpuszczalności peptydów1-2.

Referencje

Odniesienie
3.0 Modyfikacje C-końca
3.1 Amid (Amidacja)
C-koniec peptydu jest syntetyzowany jako amid w celu zneutralizowania ujemnego ładunku utworzonego przez C-końcowy COOH. Ta modyfikacja jest dodawana w celu zapobiegania degradacji enzymów, naśladowania natywnych białek, a w niektórych przypadkach w celu usunięcia wiązania wodorowego na C-końcu peptydów, które może zakłócać testy.1
Odniesienie
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?