Katalizatory palladowe na bazie NHC
We współpracy z Umicore AG and Co,1 oferujemy serię solidnych kompleksów Pd(II) i Pd(0) stosowanych jako łącznik w reakcjach tworzenia wiązań C-C. Wysokowydajne katalizatory Pd mogą skutecznie sprzęgać chlorki alkilowe i arylowe ze związkami organoboronowymi na dużą skalę (100 g-100 t).2 Wysokie TON, łagodne warunki reakcji i ekonomiczna opłacalność/dostępność chlorków arylowych sprawiają, że ta metodologia jest atrakcyjna dla zastosowań na skalę przemysłową. Katalizatory 1 i 2 wykazują doskonałą aktywność w reakcjach sprzęgania C-C. Są one formalnie Pd(0) i są rzadkimi przykładami dobrze scharakteryzowanych monokarbenowych prekursorów palladu do kompleksów 12-elektronowych. System Umicore NHC-Pd przeprowadza sprzężenia Suzuki i Kumada, jak również reakcje α-arylacji w rozsądnych temperaturach.
W tym ostatnim przypadku [(NHC)Pd(allil)Cl],2 reaktywny, formalnie 16-elektronowy kompleks, pośredniczy w α-arylacji szeregu ketonów arylowych (Schemat 1).3 Stabilny w powietrzu katalizator, krótkie czasy reakcji i wysokie konwersje dowodzą przydatności tej technologii NHC w porównaniu z poprzednimi α-arylacjami katalizowanymi Pd. Reaktywność ketonów alkiloalkilowych i alkiloarylowych została zbadana w tym wczesnym artykule NHC-Pd autorstwa Nolana i współpracowników.

Schemat 1. α-arylowanie szeregu ketonów arylowych
[{Pd(IMes)(NQ)}2] wykazał wysoką reaktywność i selektywność w sprzężeniach sp3-sp2 Kumada (Schemat 2).4 Ogólność tej metodologii rozciąga się zarówno na bogate w elektrony, jak i ubogie w elektrony odczynniki arylomagnezowe. Co więcej, szerokie spektrum funkcjonalizowanych chlorków alkilowych zostało wykorzystane do uzyskania złożonych organicznych bloków budulcowych. Wysoka wydajność produktu w temperaturze pokojowej potwierdza solidność systemu katalitycznego w porównaniu z dobrze znanymi katalizatorami Pd-fosfinowymi (Pd(PPh3)4, Pd2dba3) w funkcji warunków reakcji.

Schemat 2.Sprzęgła Kumada
Powiązany katalizator [{Pd(IPr)(NQ)}2] 1 wykazał imponującą aktywność w sprzęganiu Suzuki-Miyaura chlorków arylowych z kwasami fenyloboronowymi (Schemat 3). W temperaturze 50 °C, reakcja o wysokiej wydajności (88%) została zakończona w ciągu jednej godziny przy obciążeniu katalizatora 0,5% mol.5 Co ciekawe, katalizator Pd(0) 1 dawał niższe wydajności sprzężonego produktu biarylowego w temperaturze pokojowej, podczas gdy analogiczny katalizator 2 dawał 86% wydajności 4-Cl-bifenylu zarówno w temperaturze pokojowej jak i 50 °C w identycznych warunkach. Przypuszczalnie katalizator 1 potrzebuje dodatkowej energii, aby przekroczyć barierę aktywacji i wejść w cykl katalityczny jako nagi gatunek Pd-NHC. Należy zauważyć, że reaktywność [{Pd(IPr)(NQ)}2] była również wysoka w sprzęganiu sterycznie obciążonego chlorku 2,6-difenylu i kwasu 1-naftalenoboronowego.

Schemat 3. Sprzęganie Suzuki-Miyaura chlorków arylowych
Beller i współpracownicy ustalili profil reaktywności dla katalizatorów naftochinonowych NHC-Pd w reakcjach Hecka (Tabela 1).6 Wyjątkową wydajność tego systemu ilustruje poniższy schemat, w którym najlepsze wydajności stilbenu uzyskano w temperaturze 140 °C w środowisku cieczy jonowej. Niskie obciążenie katalizatora (0,5% mol), tanie odczynniki chlorku arylu i ustabilizowane środowisko cieczy jonowej przyczyniają się do potencjalnego rozwoju tej chemii na arenie przemysłowych chemikaliów.
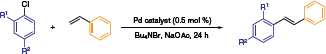
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?