Ligandy DuPhos i BPE
Wprowadzenie
Asymetryczne reakcje uwodornienia stanowią idealny proces do komercyjnej produkcji związków o jednym enancjomerze, ze względu na łatwość, z jaką te solidne procedury mogą być skalowane oraz ze względu na niski poziom produktów ubocznych generowanych w tych asymetrycznych uwodornieniach. Najskuteczniejsze systemy uwodornienia opierają się na modyfikacji właściwości elektronowych i sterycznych ligandów. Burkowi i współpracownikom udało się opracować wysoce skuteczną klasę chiralnych ligandów fosfolanowych o nazwie DuPhos i BPE, które zawierają 2,5-dipodstawione grupy pozwalające na systematyczną zmianę środowiska sterycznego wokół metalu.1 We współpracy z Kanata Chemical Technologies mamy przyjemność zaoferować zróżnicowaną gamę ligandów fosfolanowych DuPhos i BPE, które mogą być ligowane z kompleksami metali w celu uzyskania wysoce aktywnych katalizatorów do asymetrycznego uwodornienia i innych innowacyjnych transformacji.2
Zdolność tych wytrzymałych katalizatorów na dużą skalę obserwuje się w wydajności (stosunek substratu do katalizatora (S/C) do 50 000) i wysokiej aktywności (TOF > 5000 h-1) w niezliczonych redukcjach enamidów i ketonów. W zoptymalizowanych warunkach, (R,R)-Me-BPE-Rh redukował N-acetylo α-arylenamidy w > 95% ee dając cenne α-1-aryloetyloaminy (Schemat 1).3

Należy zauważyć, że kompleksy Me-DuPhos-Rh były równie skuteczne w asymetrycznej redukcji prochiralnych enamidów. Ogólną użyteczność tych ligandów fosfolanowych ilustruje niesamowita różnorodność zorientowana na produkcję szerokiej gamy związków chiralnych (Schemat 2).

Zalety ligandów DuPhos i BPE:
- Najwyższa enancjokontrola w transformacjach katalitycznych zorientowanych na różnorodność
- Wysoka aktywność przy niskich ładunkach katalizatora
- Wyjątkowa chemoselektywność dla określonych paradygmatów reakcji
- Asymetryczne uwodornienie wielu nienasyconych substratów
- Dostępny zestaw przesiewowy ułatwiający dostrojenie selektywności
- Wyłączność na rynku dla wybranych ligandów z portfolio
Reprezentatywne zastosowania:
Profil reaktywności tych innowacyjnych, chiralnych ligandów został opisany poniżej i podkreśla imponujący zakres cennych transformacji, w których pośredniczą różne produkty z portfolio. W wielu udokumentowanych przypadkach określone ligandy wykazały bezprecedensową selektywność w reakcjach, które tworzą na przykład centra chiralne w organicznych blokach budulcowych funkcjonalizowanych heteroatomem do syntezy leków.
Asymetryczne uwodornienie grupy C=N
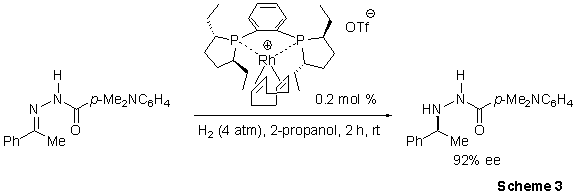
Burk i współpracownicy wykorzystali wysoką aktywność liganda Ethyl-DuPhos poprzez silny katalityczny proces aminowania redukcyjnego.4 Procedura wykazuje ogólne zastosowanie w redukcji szerokiej gamy N-aroilo-hydrazonów, dając enancjoselektywność dla większości substratów > 90% (Schemat 3). Dodatkowo, ten katalizowany układ (Et-DuPhos)-Rh wykazuje wyjątkowo wysoką chemoselektywność, dając niewielką lub żadną redukcję niefunkcjonalizowanych alkenów, alkinów, ketonów, aldehydów i imin w eksperymentach konkurencji. Syntetyczną użyteczność tych asymetrycznych redukcji hydrazonów zwiększa ich łatwa reakcja w temperaturze otoczenia z dijodkiem samaru, która przebiega bez zauważalnej utraty czystości optycznej.
Katalityczne uwodornienie enamidów
Burk był również pionierem asymetrycznego uwodornienia różnych enamidoolefin, dając wysoce enancjopurystyczneδ,γ-nienasycone produkty aminokwasowe.5 System katalityczny (S,S)-(Et-DuPhos)-Rh kontroluje reaktywność sprzężonych substratów z wysoką regioselektywnością. W standardowych warunkach uwodornienia (S/C =500, ciśnienie H2 w zakresie od 60 do 90 psi i 0,5-3 h), katalizator ten dawał mniej niż 2% nadredukcji ze wszystkimi produktami wyizolowanymi z wydajnością lepszą niż 95%. Autorzy rozwinęli tę wyjątkową reaktywność katalizatora, demonstrując zwięzłą i wysoce selektywną syntezę naturalnego produktu (-)-bulgecyny, poprzedzoną utworzeniem kluczowego chiralnego półproduktu z 99% wydajnością i 99,3% ee (Schemat 4).

Wysoko asymetryczne amidowanie redukcyjne
Burk i współpracownicy zilustrowali również szybki trzyetapowy proces amidowania redukcyjnego, przekształcający różne ketony w odpowiednie chiralne aminy z wysoką enancjoselektywnością.6 Należy zauważyć, że transformacja pokazana poniżej obejmuje reakcję ketonu z hydroksyloaminą, a następnie redukcję metalem żelaza. Metodologia ta korzysta z wykorzystania surowych enamidów wyizolowanych jako krystaliczne ciała stałe w bezpośrednim asymetrycznym katalitycznym uwodornieniu bez wcześniejszego oczyszczania. Konwersja 1-acetyladamantanu do nowego związku aminowego zachodzi z >99% ee i z wysoką wydajnością dzięki zastosowaniu kationowego katalizatora Rh(I) 1 (Schemat 5).

Preparacja chiralnych związków organicznych z centrami stereogenicznymi C-O

Neil Boaz wykorzystał również katalizator rod(I)-((R,R)-Me-DuPhos) do produkcji chiralnych alkoholi poprzez asymetryczne uwodornienie estrów enolowych. Pochodne alkoholi allilowych są pożądanymi organicznymi blokami budulcowymi w syntezie zorientowanej na różnorodność, ponieważ olefina może być dalej funkcjonalizowana po ustaleniu stereochemii w uwodornieniu.7 W warunkach asymetrycznego uwodornienia, początkowo utworzony octan propargilowy został następnie zredukowany z wytworzeniem octanu allilowego. Imponująco, enancjoselektywność obserwowana w tej reakcji była bardzo wysoka wśród ogólnej klasy substratów 2a-c.

Burk i współpracownicy zaprojektowali również wysoce efektywne katalizatory do asymetrycznej redukcji wiązań C=O w warunkach uwodornienia.8 W poniższym przypadku metodologia przebiegała poprzez zastosowanie chiralnego kompleksu Ru(II)Br2-(i)-Pr-BPE), który został przygotowany w reakcji [(COD)Ru(2-methylallyl)2] z ligandem BPE, a następnie potraktowany metanolowym HBr. Różnorodne estry zostały szybko uwodornione za pośrednictwem tego katalizatora do estrów hydroksylowych z bardzo wysoką enancjoselektywnością w zakresie od > 98% ee dla substratów podstawionych alkilami (por. Schemat 7).

Preparation of Chiral Organics with C-C Stereogenic Centers
Jako uzupełnienie asymetrycznej syntezy tworzącej wiązanie C-O, Burk i współpracownicy przeprowadzili wysoce enancjoselektywne uwodornienia unikalnych substratów będących prekursorami produktów naturalnych. Metodologia ta wyróżnia się enancjoselektywnością zbliżającą się do 100% i wysokimi wydajnościami (S/C > 2500) i pozwoliła temu zespołowi badawczemu przezwyciężyć problemy związane z asymetryczną syntezą leku candoxitril (Schemat 8).9
Nowe asymetryczne [4+1] cykloaddycje
Te wysoce praktyczne enancjoselektywne reakcje zostały przeprowadzone przez grupę badawczą Murkami, rozszerzając w ten sposób syntetyczną użyteczność tych potężnych chiralnych ligandów.10 Cykloaddycja [4+1] między winylalenami i tlenkiem węgla daje złożone pochodne cyklopentenonu w jednym etapie i z enancjopurytycznością do 95% (Schemat 9).

Katalizowana palladem asymetryczna fosforylacja
Glueck i współpracownicy z powodzeniem opracowali katalityczną reakcję asymetrycznej fosforylacji wykorzystywaną do produkcji P-chirogennych fosfin (Schemat 10).11 Szybka konwersja, umiarkowane obciążenie katalizatora i enancjoselektywność pozwalają na szybką konstrukcję enancjowzbogaconych fosfinowych bloków budulcowych. Katalizowane metalami drogi do tych cennych P-chiralnych ligandów są rzadkie, co czyni tę metodologię atrakcyjną jako realną drogę do syntezy innych ligandów fosfinowych.

Katalityczna asymetryczna alkilacja N-difenylofosfinoilimin
Ostatnio Charette opublikował łatwą asymetryczną syntezę różnych a-chiralnych amin poprzez enancjoselektywną addycję odczynników dialkilocynkowych do N-fosfinoilimin.12 (R,R)-Me-DuPhos, w połączeniu ze źródłem Cu(OTf)2 dał wyjątkowy nadmiar enancjomeryczny dla tego paradygmatu reakcji powyżej 90% dla wszystkich substratów aromatycznych (Schemat 11). Łagodne warunki reakcji, rozsądne temperatury i zastosowanie różnych odczynników dialkilocynkowych przyczyniają się do atrakcyjności tej metodologii.

Wnioski
Modułowa natura tych chiralnych ligandów fosfolanowych pozwoliła na zmianę elektroniki i steryczności wokół metalu podczas kompleksowania. Te bidentne ligandy przeprowadzają wysoce enancjoselektywne reakcje uwodornienia w celu wytworzenia szerokiej gamy związków zawierających centra stereogeniczne C-C, C-O i C-N. Jesteśmy dedykowanym źródłem szerokiego spektrum bloków budulcowych, które zapewniają niezbędne materiały wyjściowe w syntezie złożonych cząsteczek organicznych. Nasze rosnące portfolio produktów katalitycznych, uzupełnione o rodzinę DuPhos/BPE, silnie uzupełnia naszą istniejącą linię chemiczną i przyspieszy sukces badawczy.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?