Katalizatory cataCXium®
Wprowadzenie
Reakcje sprzęgania krzyżowego są ważną klasą przemian katalitycznych mających zastosowanie w nauce o polimerach, a także w przemyśle chemicznym i farmaceutycznym. Wykorzystanie chlorków arylowych do tych transformacji jest preferowane ze względu na ich niski koszt i dostępność. Jednakże, pomimo ogromnego postępu dokonanego w projektowaniu katalizatorów, obciążenie Pd dla tych reakcji
(1-3 mol%) uniemożliwia przemysłowi stosowanie ich w skali kilogramowej. Dążenie do syntezy bardzo aktywnego katalizatora o bardzo niskim obciążeniu trwa od 20 lat.
- Ekonomiczna metoda atomowa
- Wysokie wydajności
- Wysokie liczby obrotowe
Suzuki Coupling with Low Loading of Catalyst<
Beller i współpracownicy opracowali bardzo nieporęczny ligand oparty na diadamantylalkilofosfanach.1,2,3 Wśród najbardziej aktywnych ligandów zsyntetyzowanych przez tę grupę, diadamantylo-n-butylofosfan okazał się najbardziej wydajny. Stosując 0,005 mol% Pd(OAc)2 i 0,01 mol% fosfiny, odnotowano dobre do doskonałych wydajności (58-100%) (Schemat 1). Należy zauważyć, że podstawniki orto na chlorku arylowym są tolerowane i że tylko silnie donorowe podstawniki, takie jak grupa metoksylowa, prowadziły do spadku wydajności (60%) (Tabela 1).

Schemat 1
Evonik, we współpracy z profesorem Bellerem i współpracownikami, opracował nową klasę ligandów fosfinowych, podstawionych fosfinowo N-arylowych piroli.4 Te biarylowe ligandy są sterycznie wymagające i bogate w elektrony. Po zastosowaniu do reakcji różnych chlorków arylowych z kwasem fenyloboronowym, wykazały one bardzo wysokie liczby obrotowe w łagodnych temperaturach reakcji. Niskie obciążenie katalizatora (0,05 mol%) było potrzebne do krzyżowego sprzęgania różnych chlorków arylowych z kwasem fenyloboronowym (Schemat 2). Wykorzystanie tego ligandu z Pd(OAc)2 lub Pd2(dba)3, do konwersji bogatych i ubogich w elektrony chlorków arylowych, dało doskonałe wydajności. Tabela 2 podsumowuje wydajność dla różnych chlorków arylowych poddanych reakcji z kwasem fenyloboronowym przy użyciu 0,01 mol% Pd2(dba)3 w temperaturze 60 °C.
.

Schemat 2
Bazując na sukcesie syntezy fosfino-N-arylopiroli, Beller i współpracownicy opracowali podobny ligand. Zsyntetyzowali ligandy oparte na fosfino-N-fenyloindolu.5 Aby ocenić reaktywność tych ligandów, przeprowadzili reakcję krzyżowego sprzęgania chlorobenzenu z aniliną (Schemat 3). Ten nowy system okazał się najlepszy spośród różnych ligandów opracowanych przez Beller i współpracowników dla tej specyficznej reakcji krzyżowego sprzęgania. Stosując Pd(OAc)2 i tert-butylofosfinowy ligand fenyloindolowy z NaOtBu jako zasadą w toluenie, szeroką gamę amin arylowano z doskonałą wydajnością.
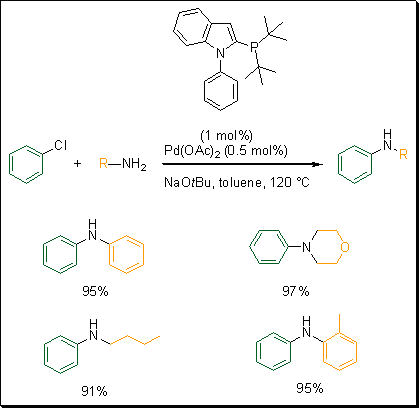
Schemat 3
Referencje
Reakcje sprzęgania krzyżowego
Nowa klasa ligandów fosforowych została opracowana przez Plenio i współpracowników w oparciu o architekturę fluorenylofosfin.1 Aby przetestować moc tych nowych ligandów, zespół naukowców przeprowadził kilka typowych reakcji sprzęgania krzyżowego: Suzuki, Sonogashira i aminowanie Buchwalda-Hartwiga (Rysunek 1). Ligand okazał się bardzo aktywny w sprzęganiu Suzuki różnych chlorków arylowych z kwasem 4-metylofenyloboronowym przy obciążeniu od 0,05 do 0,5 mol% palladu. Podstawnik donorowy, taki jak OMe, nie wpływał na wydajność z 99% konwersją. Transformacja Sonogashira została przeprowadzona z różnymi chlorkami arylowymi sprzężonymi z fenyloacetylenem. Przy obciążeniu katalizatora 1 mol% odnotowano wydajności od 44% do 94%. Wreszcie, wyniki aminowania Buchwalda-Hartwiga były bardzo obiecujące, z ilościową konwersją zgłoszoną dla kilku reakcji przy obciążeniu katalizatora tak niskim jak 0,1 mol%.
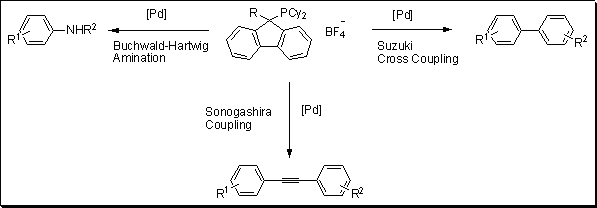
Rysunek 1.
Referencje
Kataliza Hecka
Hermann i współpracownicy opracowali nową klasę katalizatorów palladowych o nazwie palladacycles.1 Kompleksy te są stabilne termicznie do 100 °C i są bardzo silne w katalizie Hecka z TON > 10,000. Tietze i in. wykorzystali aktywność tego katalizatora do syntezy pochodnej cefalostatyny, steroidu, który wykazał silne działanie przeciwko komórkom nowotworowym.2 Reakcję podwójnego sprzęgania przeprowadzono z ogólną wydajnością 80%.

Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?