MonoBeads: Oczyszczanie miligramowych ilości z najwyższą rozdzielczością
Używaj MonoBeads do oczyszczania białek, peptydów lub oligonukleotydów.
Używaj MonoBeads do etapów polerowania w skali laboratoryjnej, gdy niezbędna jest najwyższa rozdzielczość i wymagana jest większa pojemność niż MiniBeads.
Używaj MonoBeads do wychwytywania lub oczyszczania pośredniego, gdy wymagane są miligramowe ilości, gdy nie ma wymogu zwiększania skali i/lub gdy wstępnie zapakowane kolumny MiniBead nie oferują wystarczającej pojemności. Należy pamiętać, że aby uniknąć zablokowania kolumny, szczególnie ważne jest usunięcie cząstek stałych przed użyciem MonoBeads.
Uruchom MonoBeads w systemach takich jak ÄKTAdesign, FPLC System i HPLC. Dodatek 4 zawiera wskazówki dotyczące wyboru najbardziej odpowiedniego systemu ÄKTAdesign.
Nośniki jonowymienne Mono Q i Mono S są oparte na hydrofilowej matrycy wykonanej z monodyspersyjnych, sztywnych cząstek polistyrenu/diwinylobenzenu, podstawionych czwartorzędowymi grupami amoniowymi (Q) lub metylosulfonianowymi (S) (Rysunek 32). Ta kombinacja nadaje nośnikom ekstremalną stabilność chemiczną i fizyczną. Małe rozmiary cząstek (10 μm) umożliwiają szybkie wiązanie i dysocjację w celu ułatwienia wysokiej rozdzielczości, podczas gdy jednorodność cząstek zapewnia wysokie prędkości przepływu przy niskim ciśnieniu wstecznym. Silne grupy jonowymienne (Q i S) utrzymują swój ładunek w szerokim zakresie pH (rys. 33), umożliwiając wybór najbardziej odpowiedniego pH dla każdego zastosowania.

Rysunek 32. Mikrografia elektronowa MonoBeads pokazująca ich wyraźną monodyspersyjność.
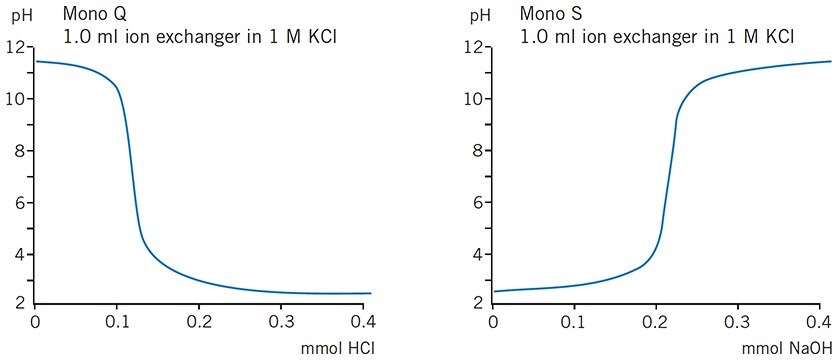
Rysunek 33. Krzywe miareczkowania dla Mono Q i Mono S™. Zdolność wiązania pozostaje stała w szerokim zakresie roboczym pH.
Opcje oczyszczania

Rysunek 34. MonoBeads (Q i S) są dostępne w gotowych opakowaniach w kolumnach Tricorn PE (PEEK) i Tricorn GL (szkło).
*Pracujący zakres pH odnosi się do przedziału pH, w którym pożywka wiąże białko zgodnie z przeznaczeniem lub zgodnie z potrzebami elucji bez niekorzystnych skutków długoterminowych.
**Maksymalne przeciwciśnienie robocze odnosi się do ciśnienia, powyżej którego medium zaczyna się kompresować.
Przykłady oczyszczania
Dwuetapowe oczyszczanie z wykorzystaniem uzupełniających się selektywności
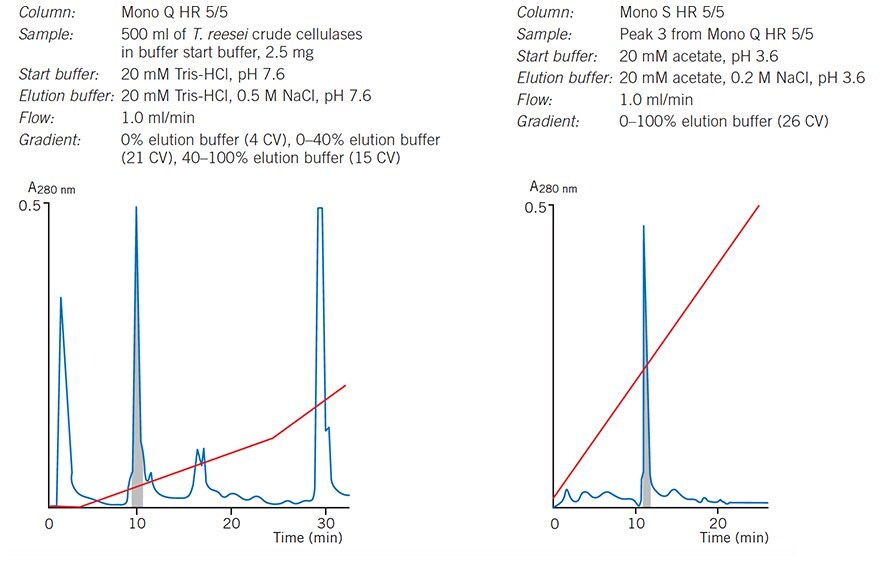
Rysunek 35. Oczyszczanie celulozy na kolumnach Mono Q i Mono S HR 5/5 (obecnie dostępnych jako Mono Q 5/50 GL i Mono S 5/50 GL).
Wysoka rozdzielczość, etap polerowania

Wykres 36. Końcowy etap oczyszczania białka wiążącego DNA, transpozazy TniA. Dwa dobrze rozdzielone piki po separacji na Mono S 5/50 GL (a). Analiza SDS-PAGE pokazuje frakcje z każdego z trzech etapów zastosowanych w tym protokole (b), PhastSystem™ przy użyciu SDS-PAGE PhastGel™ Homogenous - 12.5 i barwienia Coomassie™.
Długoterminowa odtwarzalność
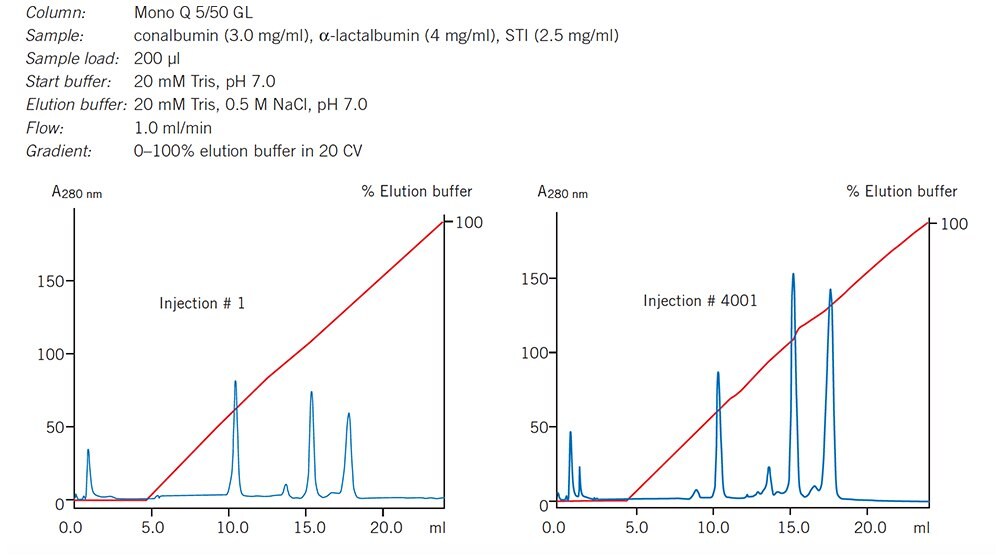
Wykres 37. Chromatogramy ilustrujące powtarzalność serii dla Mono Q 5/50 GL (Tricorn). Pokazano przebiegi 1, 1000 i 2000.
Separacja w rozpuszczalnikach organicznych

Wykres 38. Rozdzielanie peptydu bacytracyny na Mono S HR 5/5 (obecnie dostępny jako Mono S 5/50 GL).
Wykonywanie separacji
Wytyczne dotyczące wyboru pożywki, buforu, pH i siły jonowej oraz optymalizacji metody podano w Rozdziale 2.
Prawidłowe przygotowanie próbki i buforu ma zasadnicze znaczenie dla osiągnięcia optymalnej separacji i uniknięcia pogorszenia wydajności kolumny, zwłaszcza w przypadku stosowania małych cząstek, takich jak MonoBeads. Próbki muszą być w pełni rozpuszczone i wolne od cząstek lub innych materiałów, które mogą zakłócać separację. Zalecenia i porady dotyczące przygotowania próbek można znaleźć w Rozdziale 2 i Załączniku 1
Bufory filtracyjne po dodaniu wszystkich soli i dodatków. Używaj wysokiej jakości wody i chemikaliów. Filtruj roztwory przez filtry 0,22 μm. Aby uniknąć tworzenia się pęcherzyków powietrza w upakowanej kolumnie, upewnij się, że kolumna i bufory mają tę samą temperaturę podczas przygotowywania do przebiegu.
FH buforu początkowego powinno wynosić co najmniej 0,5-1 jednostki pH powyżej pI substancji docelowej w przypadku stosowania wymieniacza anionowego (Q) i 0,5-1 jednostki pH poniżej pI substancji docelowej w przypadku stosowania wymieniacza kationowego (S). Zalecenia dotyczące lotnych i nielotnych układów buforowych dla wymieniaczy anionowych i kationowych znajdują się w Załączniku 2
W przypadku próbek o nieznanych właściwościach ładunku należy wypróbować następujące metody:
- wymieniacz anionowy (Q)
bufor startowy: pH 8.0
bufor elucyjny: bufor startowy zawierający 1 M NaCl, pH 8.0 - wymiana kationów (S)
bufor startowy: pH 6.0
bufor elucyjny: bufor startowy zawierający 1 M NaCl, pH 6.0
Użytkownicy systemów ÄKTAdesign z funkcją BufferPrep mogą wybrać jedną z receptur buforowych zalecanych do chromatografii anionowymiennej przy pH 8 lub chromatografii kationowymiennej przy pH 6.
Pierwsze użycie lub po długim okresie przechowywania
- Aby usunąć etanol, należy przemyć kolumnę 5 objętościami wody destylowanej z prędkością 1 mL/min (kolumny 1,7 mL i 1 mL), 2 mL/min (kolumna 8 mL) lub 4 mL/min (kolumna 20 mL). Etap ten zapewnia usunięcie etanolu i pozwala uniknąć ryzyka wytrącenia, gdyby sole buforowe weszły w kontakt z etanolem. Etap ten można pominąć, jeśli wytrącanie nie będzie stanowić problemu.
- Płukanie 5 objętościami buforu startowego z prędkością 2 mL/min (kolumny 1,7 mL i 1 mL), 4 mL/min (kolumna 8 mL) lub 8 mL/min (kolumna 20 mL).
- Płukanie 5 objętościami buforu elucyjnego, taki sam przepływ jak w etapie 2.
- Przepłukać 5 objętościami buforu startowego, taki sam przepływ jak w kroku 2.
- Przeprowadzić ślepą elucję przed nałożeniem próbki.
Separacja przez elucję gradientową
Przepływ: 2 mL/min (kolumna 1,7 mL), 2 mL/min (kolumna 1 mL), 4 mL/min (kolumna 8 mL) lub 8 mL/min (kolumna 20 mL).
- Kolumnę należy skalibrować za pomocą 5-10 objętości buforu startowego lub do momentu, gdy linia bazowa, pH eluentu i przewodność będą stabilne.
- Dostosuj próbkę do wybranego początkowego pH i siły jonowej i nałóż na kolumnę.
- Przepłukać kolumnę 5-10 objętościami buforu startowego lub do momentu, gdy wartość wyjściowa, pH eluentu i przewodność będą stabilne, tj. gdy cały niezwiązany materiał zostanie przepłukany przez kolumnę.
- Rozpocząć elucję przy użyciu gradientu o objętości 10-20 objętości kolumny i rosnącej sile jonowej do 0,5 M NaCl (50%B).
- Przepłukać 5 objętościami kolumny 1 M NaCl (100%B) w celu elucji pozostałego materiału związanego jonowo.
- Re-wyrównać za pomocą 5-10 objętości kolumny buforu startowego lub do momentu, gdy pH i przewodność eluentu osiągną wymagane wartości.
Rozdzielanie przez elucję krokową
Chociaż rozdzielanie przez elucję krokową (patrz Rozdział 1, strona 19) może być wykonywane przy użyciu MonoBeads, zaleca się elucję gradientową w celu osiągnięcia najwyższej możliwej rozdzielczości.
Oszczędzaj czas, stosując wyższe szybkości przepływu podczas etapów płukania wysoką solą i ponownej elucji. Nie przekraczaj maksymalnego zalecanego przepływu dla kolumny.
Jeśli użyto detergentów jonowych, przemyj kolumnę 5 objętościami wody destylowanej, a następnie 2 objętościami 2 M NaCl. Ponownie skalibrować za pomocą co najmniej 10 objętości kolumny buforu startowego, aż linia bazowa UV, pH eluentu i/lub przewodność będą stabilne. Rozpuszczalniki organiczne, takie jak etanol, mogą być używane do usuwania niejonowych detergentów. Wybierając rozpuszczalnik organiczny, należy sprawdzić stabilność chemiczną medium, aby określić odpowiednie stężenie.
Regularnie sprawdzaj wydajność kolumny, określając wydajność kolumny i symetrię piku. Patrz Dodatek 3. Wskazówki dotyczące optymalizacji separacji znajdują się w Rozdziale 2 .
Czyszczenie
Prawidłowe przygotowanie próbek i buforów oraz zastosowanie płukania o wysokiej zawartości soli (1 M NaCl) na końcu każdej separacji powinno utrzymać większość kolumn w dobrym stanie. Jednak obniżona wydajność, wolne tempo przepływu, rosnące ciśnienie wsteczne lub całkowite zablokowanie wskazują, że medium należy oczyścić przy użyciu bardziej rygorystycznych procedur w celu usunięcia zanieczyszczeń.
Zaleca się odwrócenie kierunku przepływu podczas czyszczenia kolumny, aby zanieczyszczenia nie musiały przechodzić przez całą długość kolumny. Liczba objętości kolumn i czas wymagany dla każdego etapu czyszczenia mogą się różnić w zależności od stopnia zanieczyszczenia. Jeśli procedura czyszczenia w celu usunięcia typowych zanieczyszczeń nie przywróci wydajności kolumny, należy wymienić górny filtr przed wypróbowaniem alternatywnych metod czyszczenia. Należy zachować ostrożność podczas wymiany filtra, ponieważ może to wpłynąć na wypełnienie kolumny i zakłócić jej działanie.
Następująca procedura powinna być zadowalająca w celu usunięcia typowych zanieczyszczeń:
- Płukanie co najmniej 2 objętościami kolumny 2 M NaCl przy 0.2 mL/min (kolumna 1,7 mL), 0,5 mL/min (kolumna 1 mL), 2 mL/min (kolumna 8 mL) lub 5 mL/min (kolumna 20 mL).
- Płukanie co najmniej 4 objętościami kolumny 1 M NaOH (taki sam przepływ jak w kroku 1).
- Płukanie co najmniej 2 objętościami kolumny 2 M NaCl (taki sam przepływ jak w kroku 1).
- Płukać co najmniej 2 objętościami wody destylowanej w kolumnie (taki sam przepływ jak w kroku 1), aż linia bazowa UV i pH eluentu będą stabilne.
- Płukać co najmniej 4 objętościami buforu startowego lub buforu do przechowywania w kolumnie (taki sam przepływ jak w kroku 1), aż wartości pH i przewodności osiągną wymagane wartości.
Aby usunąć wytrącone białka, lipidy, hydrofobowo związane białka lub lipoproteiny, patrz Załącznik 1.
Charakterystyka nośnika
Skład: sztywne, monodyspersyjne cząstki polistyrenu/diwinylobenzenu (10 μm) o zoptymalizowanym rozkładzie wielkości porów. Matryca bazowa jest podstawiona czwartorzędowymi grupami aminowymi (Q) lub metylosulfonianowymi (S).
*Długoterminowa stabilność pH odnosi się do przedziału pH, w którym medium jest stabilne przez długi okres czasu bez negatywnych skutków ubocznych dla wydajności chromatografii.
Krótkoterminowa stabilność pH odnosi się do przedziału pH dla procedur regeneracji, czyszczenia na miejscu i odkażania.
Wszystkie zakresy są szacunkowe w oparciu o doświadczenie i wiedzę firmy Cytiva.
Stabilność chemiczna
Do codziennego użytku MonoBeads są stabilne we wszystkich powszechnie stosowanych buforach wodnych w zakresie pH 2-12 oraz w obecności dodatków, takich jak środki denaturujące (8 M mocznik lub 6 M chlorowodorek guanidyny), niejonowe lub jonowe detergenty oraz do 20% acetonitrylu w buforach wodnych. Należy pamiętać, że wodne roztwory mocznika, glikolu etylenowego i podobnych związków zwiększą przeciwciśnienie ze względu na zwiększoną lepkość.
MonoBeads mogą być stosowane z roztworami organicznymi, takimi jak dimetylosulfotlenek, dimetyloformamid lub kwas mrówkowy, ale właściwości separacyjne mediów ulegną zmianie.
Unikać detergentów anionowych z Mono Q. Unikać detergentów kationowych z Mono S. Unikać środków utleniających.
Przechowywanie
W celu przechowywania kolumny, przemyć 5 objętościami wody destylowanej, a następnie 5 objętościami 20% etanolu. Dokładnie odgazuj mieszaninę etanolu i wody i stosuj przy niskim natężeniu przepływu, aby uniknąć nadmiernego nacisku na kolumnę. Przechowywać w temperaturze pokojowej lub przez dłuższy czas w temperaturze od +4 °C do +8 °C. Upewnij się, że kolumna jest dobrze uszczelniona, aby uniknąć wyschnięcia. Jeśli to możliwe, należy używać urządzenia do przechowywania i transportu dostarczonego przez producenta. Nie zamrażać.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?