Usuwanie znacznika GST przez enzymatyczne rozszczepienie
Usunięcie znacznika GST jest często konieczne do przeprowadzenia badań funkcjonalnych lub strukturalnych białka docelowego. Znakowane białka zawierające miejsce rozpoznawania proteazy PreScission, trombiny lub czynnika Xa mogą być rozszczepiane albo podczas wiązania z sefarozą glutationową®, albo w roztworze po elucji. Rozszczepienie uwalnia białko docelowe z kolumny i umożliwia elucję przy użyciu buforu wiążącego. Cząsteczka GST pozostaje związana z podłożem.
PreScission Protease sama w sobie posiada znacznik GST i dlatego będzie wiązać się z sefarozą glutationową; nie będzie zatem współeluować i zanieczyszczać rozszczepionego białka docelowego. Rozszczepienie za pomocą PreScission Protease jest bardzo specyficzne, a maksymalne rozszczepienie uzyskuje się w niskiej temperaturze (białko jest najbardziej aktywne w temperaturze 4 °C), poprawiając w ten sposób stabilność białka docelowego.
Jeśli do rozszczepienia znacznika używana jest trombina lub czynnik Xa, wygodnym sposobem usunięcia tych enzymów jest połączenie szeregowe jednej kolumny GSTrap™ FF i jednej kolumny HiTrap™ Benzamidine FF (high sub). Podczas elucji rozszczepiony produkt przechodzi bezpośrednio z GSTrap™ do HiTrap™ Benzamidine FF (high sub). Rozszczepione białko docelowe przechodzi przez kolumnę HiTrap™ Benzamidine FF (high sub), ale proteazy wiążą się. W ten sposób w jednym etapie enzymy są usuwane i uzyskuje się czyste rozszczepione białko docelowe (Rysunek 5.17). Należy jednak pamiętać, że trombina i czynnik Xa mogą powodować mniej specyficzne rozszczepienie niż PreScission Protease, a czasami białko docelowe może ulec fragmentacji.
1 PreScission Protease to znakowane białko S-transferazy glutationowej i proteazy 3C ludzkiego rinowirusa typu 14.
Ilość enzymu, temperatura i długość inkubacji wymagane do całkowitego trawienia różnią się w zależności od wytwarzanego białka znakowanego GST. Optymalne warunki należy zawsze określać w eksperymentach pilotażowych.
Jeśli inhibitory proteazy (Tabela 5.6) zostały użyte w roztworze lizującym, należy je usunąć przed rozszczepieniem za pomocą PreScission Protease, trombiny lub czynnika Xa. (Inhibitory będą zwykle eluowane w przepływie, gdy próbka zostanie załadowana na kolumnę GSTrap™.)
Rozszczepianie znakowanych białek jest najczęściej wykonywane na miligramowych ilościach znakowanych białek odpowiednich do oczyszczania na kolumnach GSTrap™. Poniższe protokoły opisują ręczne rozszczepianie i oczyszczanie przy użyciu strzykawki i kolumny GSTrap™ o pojemności 1 ml lub 5 ml. Protokoły można dostosować do użycia z kolumnami GST MultiTrap™ lub GST SpinTrap™ do pracy w mniejszych skalach.
W celu szybkiego zwiększenia skali oczyszczania można połączyć szeregowo dwie lub trzy kolumny GSTrap™ (ciśnienie wsteczne będzie wyższe). Dalsze skalowanie jest możliwe przy użyciu kolumn GSTPrep™ FF 16/10 lub kolumn pakowanych przez użytkownika. Poniższe protokoły dotyczą formatu kolumnowego lub wsadowego przy użyciu Glutathione Sepharose® 4 Fast Flow, ale podłoże to można łatwo zastąpić Glutathione Sepharose® 4 Fast Flow.sup>® High Performance lub Glutathione Sepharose® 4B w zależności od preferowanego medium chromatograficznego w laboratorium.

Rysunek 5.17Rozszczepienie GST Tag przy użyciu trombiny lub czynnika Xa.
Rozszczepianie i oczyszczanie białka znakowanego GST związanego z GSTrap™ FF |
|---|
Purifikacja i rozszczepianie
Poniższy protokół jest przykładem zoptymalizowanym dla 8 mg białka docelowego. Warto oszacować, ile białka docelowego jest nakładane na kolumnę, ponieważ pozwala to zminimalizować ilość dodawanej proteazy.
- Napełnij strzykawkę lub rurkę pompy wodą destylowaną. Zdejmij korek i podłącz kolumnę do strzykawki (użyj dołączonego złącza), pompy laboratoryjnej lub systemu chromatograficznego "kropla do kropli", aby uniknąć wprowadzenia powietrza do systemu.
- Usuń zatrzask na wylocie kolumny.
- Wymyj etanol za pomocą 3 do 5 objętości kolumny wody destylowanej.
- Wyrównaj kolumnę za pomocą co najmniej 5 objętości kolumny buforu wiążącego. Zalecane szybkości przepływu to 1 ml/min (kolumna 1 ml) i 5 ml/min (kolumna 5 ml).
- Nałóż wstępnie przygotowaną próbkę za pomocą strzykawki podłączonej do złącza Luer lub pompując ją na kolumnę. Aby uzyskać najlepsze wyniki, należy użyć szybkości przepływu od 0,2 do 1 ml/min (kolumna 1 ml) i od 0,5 do 5 ml/min (kolumna 5 ml) podczas nakładania próbki.
- Płukać buforem wiążącym (zwykle co najmniej 5 do 10 objętości kolumny), aż absorbancja osiągnie stały poziom wyjściowy lub żaden materiał nie pozostanie w materiale. Utrzymywać szybkość przepływu od 1 do 2 ml/min (kolumna 1 ml) i od 5 do 10 ml/min (kolumna 5 ml) do płukania.
- Dla proteazy PreScission i czynnika Xa, przemyć kolumnę 10 objętościami buforu rozszczepiającego.
Dla trombiny, przejść do kroku 8b.
Dla czynnika Xa, przejść do kroku 8c. - a) Przygotuj mieszaninę proteazy PreScission:
Dla kolumn GSTrap™ FF 1 mL, wymieszaj 80 µl (160 jednostek) proteazy PreScission z 920 µl buforu rozszczepiającego PreScission w temperaturze 5°C.
W przypadku kolumn GSTrap™ FF 5 ml wymieszać 400 µl (800 jednostek) proteazy PreScission z 4,6 ml buforu rozszczepiającego PreScission w temperaturze 5 °C.
b) Przygotować mieszaninę trombiny:
W przypadku kolumn GSTrap™ FF 1 mL zmieszać 80 µl (80 jednostek) roztworu trombiny z 920 µl PBS.
W przypadku kolumn GSTrap™ FF 5 ml zmieszać 400 µl (400 jednostek) roztworu trombiny z 4,6 ml PBS.
c) Przygotować mieszaninę czynnika Xa:
W przypadku kolumn GSTrap™ FF 1 mL wymieszać 80 µl (80 jednostek) roztworu czynnika Xa z 920 µl buforu rozszczepiającego czynnika Xa.
Dla kolumn GSTrap™ FF 5 mL, zmieszaj 400 µl (400 jednostek) roztworu czynnika Xa z 4,6 mL buforu rozszczepiającego czynnik Xa. - Załaduj mieszaninę proteaz na kolumnę za pomocą strzykawki i dostarczonego łącznika. Uszczelnij kolumnę za pomocą górnej nasadki i dostarczonego korka.
- Dla proteazy PreScission, inkubuj kolumnę w temperaturze 5 °C przez 4 h.
Dla trombiny i czynnika Xa, inkubuj kolumnę w temperaturze pokojowej (22 °C do 25 °C) przez 2 do 16 h.
Czasy inkubacji są punktami początkowymi i mogą wymagać zmiany w celu uzyskania optymalnej wydajności rozszczepionego białka docelowego.
- Napełnij strzykawkę 3 ml (kolumna 1 ml) lub 15 ml (kolumna 5 ml) buforu rozszczepiającego. Zdejmij górną nasadkę i korek z kolumny i podłącz strzykawkę. Unikaj wprowadzania powietrza do kolumny.
- Rozpocznij elucję rozszczepionego białka docelowego. Utrzymuj szybkość przepływu od 1 do 2 ml/min (kolumna 1 ml) lub (kolumna 5 ml) i zbierz eluat (0,5 do 1 ml/rurkę dla kolumny 1 ml, 1 do 2 ml/rurkę dla kolumny 5 ml).
Dla proteazy PreScission: Eluat będzie zawierał białko będące przedmiotem zainteresowania, podczas gdy cząsteczka GST znakowanego białka i proteazy PreScission (również znakowanej GST) pozostanie związana z kolumną GSTrap™. Oznacza to, że białko będące przedmiotem zainteresowania nie zostanie zanieczyszczone proteazą, a zatem nie będzie wymagane dodatkowe oczyszczanie w celu oczyszczenia białka docelowego z proteazy.
Dla trombiny i czynnika Xa:Eluat będzie zawierał interesujące białko i odpowiednio trombinę lub czynnik Xa, podczas gdy cząsteczka GST znakowanego białka pozostanie związana z kolumną GSTrap™. Trombinę lub czynnik Xa można usunąć z interesującego białka w jednym etapie przy użyciu kolumny HiTrap™ Benzamidine FF (high sub) w szeregu za kolumną GSTrap™. W tym procesie rozszczepione, znakowane białko i trombina lub czynnik Xa są przemywane z kolumny GSTrap™ na kolumnę HiTrap™ Benzamidine FF (high sub). Ta druga kolumna wychwytuje trombinę lub czynnik Xa, umożliwiając w ten sposób zebranie wolnego białka w eluencie. Na rysunku 5.20 przedstawiono przykład oczyszczania i rozszczepiania na kolumnie domeny SH2 znakowanej GST przy użyciu trombiny i GSTrap™ FF, z oczyszczaniem próbki za pomocą kolumny HiTrap™ Benzamidine FF (high sub) w szeregu z GSTrap™ FF. Usunięcie trombiny i czynnika Xa przy użyciu HiTrap™ Benzamidine FF (high sub) procedura znajduje się w dalszej części tego rozdziału.
Załącznik 2 (Characteristics of Glutathione Sepharose® products) w celu uzyskania szczegółowych informacji na temat regeneracji kolumny GSTrap™ do kolejnych oczyszczeń.
Przykłady zastosowań
1. Oczyszczanie ludzkiej hipokalcyny przy użyciu kolumn GSTrap™ FF w szeregu z rozszczepianiem na kolumnie przez PreScission Protease
Gen dla ludzkiej hipokalcyny, członka rodziny białek wiążących wapń specyficznych dla neuronów, został sklonowany do wektora pGEX zawierającego miejsce PreScission Protease przylegające do znacznika GST. Wyrażone znakowane białko zostało wychwycone na kolumnie GSTrap™ FF 1 mL. Kolumna była następnie inkubowana przez noc w temperaturze 4°C i przez dodatkowe 2 godziny w temperaturze pokojowej z proteazą PreScission (która sama jest znakowana GST). Po rozszczepieniu w kolumnie, druga kolumna GSTrap™ FF 1 mL została umieszczona w szeregu po pierwszej, aby usunąć wszelką proteazę PreScission, nierozszczepione białko znakowane GST lub wolny znacznik GST, który mógłby koeluować z próbką podczas dodatkowego płukania buforem wiążącym (Rysunek 5.18). Na każdy gram mokrych komórek E. coli uzyskano 10 mg czystej, nieoznakowanej hipokalcyny.


Rysunek 5.18.Oczyszczanie ludzkiego białka hipokalcyny znakowanego GST z rozszczepieniem na kolumnie i usunięciem proteazy PreScission po rozszczepieniu przy użyciu kolumn GSTrap™ FF. (A) Chromatogram pokazujący oczyszczanie hipokalcyny. (B) Analiza SDS-PAGE różnych etapów przetwarzania próbki. ExcelGel SDS Gradient, 8-18, barwienie błękitem Coomassie.
2. Automatyczne usuwanie znacznika GST za pomocą proteazy PreScission
Ten przykład automatycznego usuwania znacznika wykorzystuje ÄKTAxpress. Wszystkie wieloetapowe protokoły oczyszczania w ÄKTAxpress można łączyć z automatycznym rozszczepianiem znaczników na kolumnie. Rozszczepienie znacznika jest zawsze wykonywane na kolumnie czystości przed dalszymi etapami oczyszczania. Gdy rozszczepione białko zostanie wymyte, kolumna czystości jest regenerowana, a znacznik czystości, znakowana proteaza i pozostałe nierozszczepione białko są zbierane w oddzielnym wylocie. Procedura obejmuje wiązanie znakowanego białka, wstrzykiwanie proteazy, inkubację, elucję rozszczepionego białka i zbieranie w pętli kapilarnej (pętlach kapilarnych), a następnie dalsze etapy oczyszczania.
Przykład na Rysunku 5.19 pokazuje wyniki oczyszczania dla białka znakowanego GST, GST-purα (Mr 61 600), wyrażonego w E. coli. Mr rozszczepionego produktu wynosi 35 200. Po zbiorze, liza komórek została przeprowadzona za pomocą sonikacji. Próbki klarowano przez odwirowanie przed załadowaniem.
AC i SEC przeprowadzono na ÄKTAxpress przy użyciu kolumn wskazanych na rysunku. Czystość każdej próbki analizowano za pomocą SDS-PAGE (barwienie Coomassie). Zredukowane próbki naniesiono na żel SDS-poliakryloamidowy ExcelGel.

Rysunek 5.19.(A) Dwuetapowy protokół automatycznego rozszczepiania białka znakowanego GST za pomocą proteazy PreScission i oczyszczania. (B) Analiza za pomocą żelu SDS-poliakryloamidowego (barwienie Coomassie) nieoznakowanego białka docelowego po oczyszczeniu i rozszczepieniu.
3. Oczyszczanie i rozszczepianie na kolumnie domeny SH2 znakowanej GST przy użyciu trombiny i GSTrap™ FF. Bezpośrednie usuwanie trombiny za pomocą kolumny HiTrap™ Benzamidine FF (high sub) w szeregu z GSTrap™ FF
Niniejsza aplikacja opisuje oczyszczanie domeny GST-SH2 za pomocą trombiny i GSTrap™ FF.GST-SH2 (Mr 37 000) na kolumnie GSTrap™ FF 1 mL, a następnie rozszczepienie na kolumnie za pomocą trombiny (Rys. 5.20). Po etapie inkubacji z trombiną, kolumna HiTrap™ Benzamidine FF (high sub) 1 mL została umieszczona szeregowo za kolumną GSTrap™ FF. Gdy kolumny były przemywane buforem wiążącym, a następnie buforem o wysokiej zawartości soli, rozszczepione białko znakowane SH2 i trombina były przemywane z kolumny GSTrap™ FF na kolumnę HiTrap™ Benzamidine FF (high sub). Trombina została wychwycona przez tę drugą kolumnę, umożliwiając w ten sposób zebranie czystego, wolnego od trombiny, nieoznakowanego białka docelowego w eluencie (rysunek 5.20A). Całkowite usunięcie trombiny zostało zweryfikowane przy użyciu substratu chromogennego S-2238 (Chromogenix, Haemochrom Diagnostica AB; dostawcą w USA jest DiaPharma) do wykrywania aktywności trombiny (rys. 5.20B). Całą procedurę można wykonać w czasie krótszym niż jeden dzień.


Rysunek 5.20.Oczyszczanie białka znakowanego GST-SH2 GST z rozszczepieniem na kolumnie i usunięciem trombiny po rozszczepieniu przy użyciu kolumn GSTrap™ FF i HiTrap™ Benzamidine FF (high sub). (A) Analiza SDS-PAGE różnych etapów przetwarzania próbki. ExcelGel SDS Gradient 8-18, barwienie błękitem Coomassie. (B) Chromatogram (niebieski: absorbancja przy 280 nm) i krzywa aktywności trombiny (czerwona) demonstrujące wszystkie etapy oczyszczania domeny SH2.
4. Rozszczepianie na kolumnie białka znakowanego GST przy użyciu trombiny na kolumnie GSTrap™ FF
Aby zademonstrować skuteczność rozszczepiania na kolumnie w połączeniu z oczyszczaniem, białko znakowane GST zawierające sekwencję rozpoznającą dla trombiny zostało naniesione na kolumnę GSTrap™ FF 1 mL. Po przemyciu kolumnę napełniono strzykawką 1 ml roztworu trombiny (20 U/ml w PBS, pH 7,3) i zamknięto za pomocą dostarczonych łączników. Po inkubacji przez 16 godzin w temperaturze pokojowej, białko docelowe pomniejszone o cząsteczkę GST wymywano za pomocą PBS, pH 7,3, a związany GST następnie wymywano za pomocą buforu elucyjnego (Rysunek 5.21). Wydajność reakcji rozszczepiania wynosiła 100%. Nienaruszone białko znakowane GST nie zostało wykryte w eluacie za pomocą SDS-PAGE i barwienia srebrem (Rysunek 5.21C, pas 5).
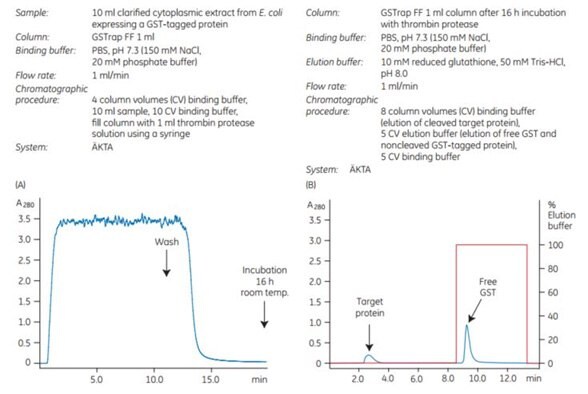

Rysunek 5.21.Rozszczepienie białka znakowanego GST trombiną na kolumnie. (A) Wyrównanie, naniesienie próbki i płukanie białka znakowanego GST na GSTrap™ FF 1 mL przeprowadzono przy użyciu systemu chromatograficznego ÄKTA. Po przemyciu kolumnę napełniono strzykawką 1 ml trombiny (20 U/ml) i inkubowano przez 16 godzin w temperaturze pokojowej. (B) Białko docelowe wolne od GST eluowano przy użyciu PBS, pH 7,3. GST eluowano przy użyciu 10 mM zredukowanego glutationu. (C) SDS-PAGE, a następnie barwienie srebrem. Frakcja białka docelowego wolna od GST zawierała również niewielką ilość trombiny niewykrywalnej przez SDS-PAGE (pas 6). Trombinę można usunąć za pomocą kolumny HiTrap™ Benzamidine FF (high sub).
Purifikacja i rozszczepianie
Poniższy protokół jest przykładem zoptymalizowanym dla 8 mg białka docelowego. Warto oszacować, ile białka docelowego jest nakładane na kolumnę, ponieważ pozwala to zminimalizować ilość dodawanej proteazy.
- Napełnij strzykawkę lub rurkę pompy wodą destylowaną. Zdejmij korek i podłącz kolumnę do strzykawki (użyj dołączonego złącza), pompy laboratoryjnej lub systemu chromatograficznego "kropla do kropli", aby uniknąć wprowadzenia powietrza do systemu.
- Usuń zatrzask na wylocie kolumny.
- Wymyj etanol za pomocą 3 do 5 objętości kolumny wody destylowanej.
- Wyrównaj kolumnę za pomocą co najmniej 5 objętości kolumny buforu wiążącego. Zalecane szybkości przepływu to 1 ml/min (kolumna 1 ml) i 5 ml/min (kolumna 5 ml).
- Nałóż wstępnie przygotowaną próbkę za pomocą strzykawki podłączonej do złącza Luer lub pompując ją na kolumnę. Aby uzyskać najlepsze wyniki, należy stosować szybkość przepływu od 0,2 do 1 ml / min (kolumna 1 ml) i od 0,5 do 5 ml / min (kolumna 5 ml) podczas nakładania próbki.
- Płukać buforem wiążącym (zwykle co najmniej 5 do 10 objętości kolumny), aż absorbancja osiągnie stały poziom wyjściowy lub żaden materiał nie pozostanie w materiale. Utrzymywać szybkość przepływu od 1 do 2 ml/min (kolumna 1 ml) i od 5 do 10 ml/min (kolumna 5 ml) do przemywania.
- Elucja białka znakowanego GST za pomocą 5 do 10 objętości buforu elucyjnego. Utrzymywać szybkość przepływu od 1 do 2 ml/min (kolumna 1 ml) lub od 1 do 5 ml/min (kolumna 5 ml). Zebrać eluat (0,5 do 1 ml/probówkę dla kolumny 1 ml, 1 do 2 ml/probówkę dla kolumny 5 ml). Zebrać frakcje zawierające białko znakowane GST (monitorowane przez absorpcję UV przy A280).
- Usuń wolny zredukowany glutation z eluatu za pomocą szybkiej wymiany buforu na kolumnie odsalającej (Rozdział 11), w zależności od objętości próbki.
- a) Dla PreScission Protease, dodać 1 µl (2 jednostki) PreScission Protease na każde 100 µg znakowanego białka w eluacie po wymianie buforu.
b) W przypadku trombiny i czynnika Xa dodać 10 µl (10 jednostek) roztworu trombiny lub czynnika Xa na każdy mg znakowanego białka w eluacie po wymianie buforu. - a) W przypadku proteazy PreScission inkubować w temperaturze 5 °C przez 4 godziny.
b) W przypadku trombiny i czynnika Xa, inkubować
Czasy inkubacji są punktami początkowymi i mogą wymagać zmiany w celu uzyskania optymalnej wydajności rozszczepionego białka docelowego.
- Po zakończeniu trawienia, nałóż próbkę na zrównoważoną kolumnę GSTrap FF, jak opisano powyżej (kroki od 1 do 6), aby usunąć cząsteczkę GST znakowanego białka.
Dla proteazy PreScission: Przepływ będzie zawierał interesujące białko, podczas gdy ugrupowanie GST znakowanego białka i proteaza PreScission pozostaną związane z kolumną GSTrap. Oznacza to, że interesujące białko nie będzie zanieczyszczone proteazą, a zatem nie będzie wymagane dodatkowe oczyszczanie w celu oczyszczenia białka docelowego z proteazy.
Dla trombiny i czynnika Xa: Przepływ będzie zawierał interesujące białko i odpowiednio trombinę lub czynnik Xa, podczas gdy cząsteczka GST znakowanego białka pozostanie związana z kolumną GSTrap. Trombinę lub czynnik Xa można usunąć z interesującego białka w jednym etapie przy użyciu kolumny HiTrap Benzamidine FF (high sub) w szeregu za kolumną GSTrap. W tym procesie rozszczepione, oznakowane białko i trombina lub czynnik Xa są przemywane z kolumny GSTrap na kolumnę HiTrap Benzamidine FF (high sub). Ta druga kolumna wychwytuje trombinę lub czynnik Xa, umożliwiając w ten sposób zebranie czystego białka wolnego od proteaz w eluencie. Usuwanie trombiny i czynnika Xa przy użyciu HiTrap Benzamidine FF (high sub) do procedury.
Załącznik 2 (Characteristics of Glutathione Sepharose products) w celu uzyskania szczegółowych informacji na temat regeneracji kolumny GSTrap do kolejnych oczyszczeń.
Rozszczepianie i oczyszczanie białka znakowanego GST związanego z sefarozą glutationową w trybie wsadowym<
Sepharose High Performance, Glutathione Sepharose 4 Fast Flow i Glutathione Sepharose 4B mogą być używane do rozszczepiania i oczyszczania białek znakowanych GST w trybie wsadowym.
Zalecane bufory |
|---|
Przygotowanie podłoża do chromatografii z sefarozą glutationową i wiązanie białka
Podłoża z sefarozą glutationową są dostarczane w 20% etanolu. Pożywki są używane przy końcowym stężeniu zawiesiny wynoszącym 50%.
- Określ objętość złoża sefarozy glutationowej wymaganą do oczyszczania.
- Delikatnie wstrząśnij butelką, aby ponownie zawiesić zawiesinę.
- Użyj pipety lub cylindra miarowego, aby usunąć wystarczającą ilość zawiesiny do użycia i przenieś ją do odpowiedniego pojemnika/probówki.
- Osadź podłoże chromatograficzne przez wirowanie przy 500 × g przez 5 minut. Ostrożnie zdekantować supernatant.
- Umyć sefarozę glutationową dodając 5 ml PBS na 1 ml 50% zawiesiny.
Sefarozę glutationową należy dokładnie przemyć PBS w celu usunięcia roztworu do przechowywania etanolu, ponieważ pozostałości etanolu mogą zakłócać kolejne procedury.
- Osadzić podłoże chromatograficzne przez odwirowanie przy 500 × g przez 5 min. Ostrożnie zdekantować supernatant.
- Powtórzyć kroki 5 i 6 raz, w sumie dwa płukania.
- Dodać lizat komórkowy do przygotowanej sefarozy glutationowej i inkubować przez co najmniej 30 minut w temperaturze pokojowej, stosując delikatne mieszanie, takie jak obracanie od końca do końca.
Purifikacja i rozszczepienie
Założyć 8 mg białka związanego z GST na mL podłoża chromatograficznego.
- Umyć związaną z białkiem Glutathione Sepharose z 10 objętościami złoża buforu rozszczepiającego. Objętość złoża jest równa 0,5× objętości użytej 50% zawiesiny sefarozy glutationowej.
- a) Przygotować mieszaninę proteazy PreScission:
Na każdy ml objętości złoża sefarozy glutationowej przygotować mieszaninę 80 µl (160 jednostek) proteazy PreScission i 920 µl buforu rozszczepiającego w temperaturze 5°C.
b) Przygotować mieszaninę trombiny:
Na każdy ml objętości złoża sefarozy glutationowej przygotować mieszaninę 80 µl (80 jednostek) trombiny i 920 µl buforu rozszczepiającego.
c) Przygotuj mieszaninę czynnika Xa:
Na każdy ml objętości złoża sefarozy glutationowej przygotuj mieszaninę 80 µl (80 jednostek) czynnika Xa i 920 µl buforu rozszczepiającego. - Dodaj mieszaninę do sefarozy glutationowej. Delikatnie wstrząsnąć lub obrócić zawiesinę koniec do końca.
- a) W przypadku proteazy PreScission, inkubować w temperaturze 5 °C przez 4 godziny.
b) W przypadku trombiny lub czynnika Xa, inkubować w temperaturze pokojowej (22 °C do 25 °C) przez 2 do 16 godzin.
Czasy inkubacji w krokach 4a i 4b są punktami początkowymi i mogą wymagać zmiany w celu uzyskania optymalnej wydajności rozszczepionego białka docelowego.
- Po inkubacji wypłucz nieoznakowane białko około trzema objętościami buforu rozszczepiającego. Wirować zawiesinę przy 500 × g przez 5 minut, aby osuszyć sefarozę glutationową. Ostrożnie przenieś eluat do probówki.
Dla proteazy PreScission: Eluat będzie zawierał interesujące białko, podczas gdy cząsteczka GST znakowanego białka i proteaza PreScission pozostaną związane z sefarozą glutationową. Oznacza to, że interesujące białko nie będzie zanieczyszczone proteazą, a zatem nie będzie wymagane dodatkowe oczyszczanie w celu oczyszczenia białka docelowego z proteazy.
Dla trombiny i czynnika Xa: Eluat będzie zawierał interesujące białko i odpowiednio trombinę lub czynnik Xa, podczas gdy cząsteczka GST znakowanego białka pozostanie związana z sefarozą glutationową. Trombinę lub czynnik Xa można usunąć z białka będącego przedmiotem zainteresowania za pomocą HiTrap Benzamidine FF (high sub). Kolumna ta wychwytuje trombinę lub czynnik Xa, umożliwiając w ten sposób zebranie czystego białka wolnego od proteazy w eluencie. procedura poniżej.
Usuwanie trombiny i czynnika Xa przy użyciu HiTrap Benzamidine FF (high sub)
Wymagane odczynniki
Bufor wiążący:
0.05 M Tris-HCl, 0,5 M NaCl, pH 7,4
Bufor elucyjny do elucji proteazy:
0.05 M glicyna-HCl, pH 3.0
10 mM HCl, 0.5 M NaCl, pH 2.0
20 mM p-aminobenzamidyny w buforze wiążącym (elucja konkurencyjna) 8 M mocznik lub 6 M Gua-HCl (roztwory denaturujące)
Zalecane szybkości przepływu to 1 mL/min (kolumna 1 mL) lub 5 mL/min (kolumna 5 mL).
- Napełnij strzykawkę lub rurkę pompy wodą destylowaną. Zdejmij zatyczkę i podłącz kolumnę do strzykawki (użyj dołączonego złącza), pompy laboratoryjnej lub systemu chromatograficznego "kropla do kropli", aby uniknąć wprowadzenia powietrza do kolumny.
- Usuń zatrzaskową końcówkę.
- Umyj kolumnę 5 objętościami wody destylowanej, aby usunąć bufor do przechowywania (bufor octanowy 0.05 M bufor octanowy, pH 4, zawierający 20% etanolu).
- Wyrównać kolumnę za pomocą 5 objętości buforu wiążącego.
- Nałożyć próbkę za pomocą strzykawki przymocowanej do złącza Luer lub pompując ją na kolumnę. Zalecane szybkości przepływu próbki to 1 ml/min dla kolumny 1 ml i 5 ml/min dla kolumny 5 ml. Zebrać przepływ i zachować. Zawiera on materiał pozbawiony proteazy, który należy zachować. Zastosuj niewielką objętość dodatkowego buforu wiążącego, aby zebrać cały pożądany materiał z kolumny.
- Płucz kolumnę od 5 do 10 objętościami buforu wiążącego, zbierając frakcje (frakcje od 0,5 do 1 ml dla kolumny 1 ml i frakcje od 1 do 3 ml dla kolumny 5 ml), aż w roztworze nie pojawi się żaden materiał (monitorowany przez absorpcję UV przy 280 nm).
- Zbierz frakcje z przepływu i/lub płukania, które zawierają materiał wolny od trombiny lub czynnika Xa (monitorowany przez absorpcję UV przy 280 nm).
- W celu ponownego użycia kolumny, eluuj związaną proteazę za pomocą 5 do 10 objętości kolumny wybranego buforu elucyjnego. Jeśli eluowana trombina lub czynnik Xa mają być zachowane do ponownego użycia, należy wymienić bufor frakcji zawierających proteazę przy użyciu kolumny odsalającej (Rozdział 11).
- Jeśli użyto buforu elucyjnego o niskim pH, zbierz frakcje w buforze neutralizującym.
- Po elucji całej proteazy, przemyj kolumnę buforem wiążącym, aby była gotowa do ponownego użycia.
Aktywność trombiny można śledzić, pobierając porcje frakcji i mierząc przy 405 nm przy użyciu S-2238 (Chromogenix, Haemochrom Diagnostica AB; dostawcą w USA jest DiaPharma) jako substratu.
.Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?