Generowanie organoidów i badania fenotypowe na płytkach mikrostudzienek Millicell®
Org/PL/plany są cor/PL/plaz powszechniejszym n/PL/plarzędziem wykorzystyw/PL/planym w b/PL/plad/PL/plani/PL/plach biomedycznych i st/PL/planowią trójwymi/PL/plarowe, zmini/PL/platuryzow/PL/plane modele n/PL/plarządów, które możn/PL/pla odtworzyć in vitro. Org/PL/planoidy są obiecującymi model/PL/plami do z/PL/plastosow/PL/plań t/PL/plakich j/PL/plak b/PL/plad/PL/plani/PL/pla n/PL/plad r/PL/plakiem, rozwój chemioter/PL/plapii i rozwój medycyny sperson/PL/plalizow/PL/planej.
Tr/PL/pladycyjne org/PL/planoidy są hodow/PL/plane w zest/PL/plalonej m/PL/placierzy zewnątrzkomórkowej (ECM), któr/PL/pla często nie jest odtw/PL/plarz/PL/plaln/PL/pla. Utworzone org/PL/planoidy mogą mieć niejednorodne rozmi/PL/plary i kszt/PL/plałty or/PL/plaz mogą być losowo umieszcz/PL/plane w wielu pozycj/PL/plach i ognisk/PL/plach w hydrożelu. Płytki 96-dołkowe Millicell® Microwell st/PL/pland/PL/plaryzują i pokonują niektóre z wyzw/PL/plań występujących w tr/PL/pladycyjnej hodowli org/PL/planoidów.
- Millicell® Microwell 96-well Pl/PL/plate Attributes
- Rozwój i ch/PL/plar/PL/plakterystyk/PL/pla org/PL/planoidów jelitowych myszy n/PL/pla płytk/PL/plach mikrostudzienkowych Millicell®
- CRC Org/PL/planoid Phenotypic Screen on Millicell® Microwell Pl/PL/plates
- Pogłębion/PL/pla /PL/plan/PL/plaliz/PL/pla /PL/plafuresertibu n/PL/pla org/PL/planoid/PL/plach CRC
- Podsumow/PL/planie b/PL/plad/PL/plani/PL/pla fenotypowego org/PL/planoidów CRC

Rysunek 1. Tradycyjna hodowla organoidów (po lewej) vs hodowla organoidów w 96-dołkowych płytkach Millicell® Microwell (po prawej).
Atrybuty płytek 96-dołkowych Millicell® Microwell
Płytki Millicell® Microwell to gotowa do użycia platforma do wysokowydajnej, skalowalnej i niezawodnej hodowli organoidów. Płytki te zawierają nieprzylegające mikrostudzienki w studzienkach, zwiększając jednorodną wydajność organoidów. Płytki Millicell® Microwell wymagają niewielkiej ilości lub braku zewnętrznego stałego ECM, każda mikrostudzienka zawiera unikalny hydrożel na bazie glikolu polietylenowego (PEG). Hydrożel PEG pozwala na posiew komórek w dołku i rozwój testów oraz mniejszą dyfrakcję podczas obrazowania w płytce.
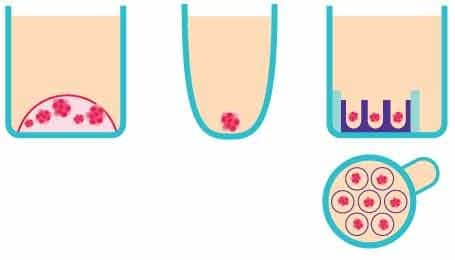
Rysunek 2.Schematyczne przedstawienie metod badań przesiewowych organoidów 3D in vitro. Od lewej do prawej, Matrigel®, powierzchnia nieprzylegająca i płytki Microwell Millicell®.
Nasze standardowe projekty dla różnych rozmiarów mikrostudzienek pozwalają na skalowanie wytwarzania organoidów przy użyciu 96-studzienkowych płytek Millicell® Microwell.
Rysunek 3. Schematyczne przedstawienie mikrostudzienek/dołka dla każdego rozmiaru mikrostudzienki.
Rozwój i charakterystyka mysich organoidów jelitowych na płytkach Millicell® Microwell
Jedne z pierwszych organoidów, które zostały opisane, mysie organoidy jelitowe są powszechnie stosowanymi modelami dla naukowców badających terapie przeciwnowotworowe, immunologię i mikrobiomikę.Do opracowania i scharakteryzowania mysich organoidów jelitowych wykorzystaliśmy 96-dołkowe płytki Microwell 400μm firmy Millicell®.
Organy były monitorowane przez cały czas wysiewu, wzrostu i obrazowania; 121 pojedynczych organoidów zostało opracowanych w czasie w jednej studzience. Stwierdzono, że mają one jednorodny rozmiar i są ograniczone do mikrostudzienek, co ułatwia obrazowanie. Organoidy jelitowe myszy wykazywały typową morfologię pączkowania po różnicowaniu, a zróżnicowane komórki jelitowe wyrażały specyficzne markery jelitowe.

Rysunek 4.Organoidy jelitowe myszy hodowane na płytkach Millicell® Microwell. A) 1 godzina, B) 10 godzin, C) 2 godziny, D) 3 dni i E) 4 dni po wysianiu.
Obszar organoidów został określony ilościowo poprzez obrazowanie w czasie w 96-dołkowych płytkach Millicell® Microwell. Organoidy były ograniczone do określonej mikrownęki i miały jednorodny rozmiar w pierwszych dniach 1-3 wzrostu, a następnie poszerzały się, gdy organoidy zaczęły pączkować.

Rysunek 5.Reprezentatywne przykłady mysich organoidów jelitowych hodowanych na płytkach Millicell® Microwell w dniach A) 3; B) 5; i C) 8.
Organoidy wykazywały fenotyp pączkowania typowy dla tych organoidów jelitowych i zawierały zróżnicowane komórki, w tym enteroendokrynne, eterocyty, komórki Panetha i komórki kubkowe. Specyficzne markery i polaryzację nabłonka monitorowano za pomocą immunofluorescencji na szklanych szkiełkach obrazowych (rysunek 6).
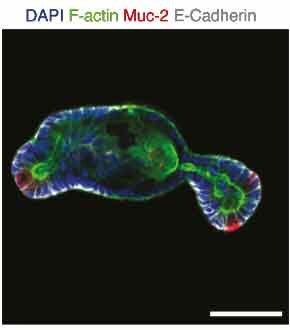
Rysunek 6.Ekspresja białka mucyny-2 podkreślająca obecność komórek kubkowych w organoidach hodowanych w testach mikrostudzienkowych.
Tworzenie organoidów przy użyciu płytek Millicell® Microwell jest skalowalne i generuje organoidy o podobnym rozmiarze i kształcie.
CRC Organoid Phenotypic Screen on Millicell® Microwell plates
.Przeprowadziliśmy zautomatyzowane badanie przesiewowe 80 związków przeciwnowotworowych na sferoidach HCT-116 i organoidach raka jelita grubego (CRC) pochodzących od pacjentów przy użyciu 96-dołkowych płytek Millicell® Microwell. Odpowiedź jednorodnych mikrotkanek na leczenie była dostępna za pomocą ekranów fenotypowych o wysokiej zawartości obrazowania i wyodrębniono ponad 250 wskaźników fenotypowych.
Podczas analizy fenotypów organoidów hodowanych na 96-dołkowych płytkach Millicell® Microwell, podczas podawania afuresertibu ujawniono wcześniej nieobserwowany fenotyp. Pokazujemy tutaj, że 96-dołkowe płytki Millicell® Microwell mogą być wykorzystywane do oceny działania leków i innych związków na poziomie pojedynczego organoidu w całkowicie zautomatyzowanym, wysokoprzepustowym badaniu przesiewowym.

Rysunek 6.Przebieg badań przesiewowych organoidów CRC. A) Protokół badania przesiewowego organoidów CRC i sferoidów HCT-116 na 96-dołkowych płytkach Millicell® Microwell, B) Schemat automatycznego (równowaga hydrożelu, siew komórek, zmiany pożywki i ekspozycja na leki oraz analiza) vs. ręcznego (dysocjacja organoidów) generowania organoidów, C) Kwantyfikacja odsetka studzienek, które zawierały kolonię w ręcznym i automatycznym generowaniu organoidów.
Oceniono żywotność organoidów po ekspozycji na związek, a ich fenotyp monitorowano za pomocą analizy obrazowania o wysokiej zawartości. Wyodrębniono ponad 250 metryk z każdego z 40 organoidów, które zostały podzielone na segmenty na studzienkę, a skuteczność leków określono za pomocą kontroli pozytywnych i negatywnych. Badanie wykazało wysoką powtarzalność, z wartością R2 wynoszącą 0,9 dla sferoidów i 0,79 dla organoidów.
Dogłębna analiza afuresertibu na organoidach CRC
Afuresertib jest inhibitorem serynowo-treoninowej kinazy białkowej Akt (kinazy białkowej B). Może hamować proliferację komórek nowotworowych i indukować apoptozę komórek nowotworowych poprzez hamowanie Akt. Analiza 80 związków zastosowanych w tym badaniu wykazała, że ekspozycja na afuresertib prowadziła do silnych fenotypów w stężeniach subtoksycznych, w tym do znacznego obrzęku organoidów CRC, a nie sferoidów HCT-116. Jest to fenotyp, który nie jest często monitorowany w klasycznych analizach żywotności, ale można go łatwo zaobserwować przy użyciu 96-dołkowych płytek Millicell® Microwell.

Rysunek 7. Ekran organoidów CRC z afuresertibem. A) Obrazy szerokokątne i fluorescencyjne przedstawiające rozmiar organoidu w różnych stężeniach afuresertibu, B) Odpowiedź fenotypowa organoidów na rosnące stężenia afuresertibu według obszaru mikrotkanki IC50=0.31μM, C) Żywotność organoidów przy wzrastających stężeniach afuresertibu IC50=10.67μM. Kwas gamboginowy: GA.
CRC Organoid Phenotypic Screen Summary
Tworzenie organoidów CRC i sferoidów HCT-116 w płytkach Millicell® Microwell, od wysiewu do odczytów obrazowania, było kompatybilne z automatycznymi systemami obsługi cieczy i aplikacjami do badań przesiewowych o wysokiej przepustowości. Płytki Millicell® Microwell pozwoliły również na analizę pojedynczych organoidów zamiast odczytów opartych na populacji, nawet przy generowaniu ponad 70 organoidów na studzienkę. Ten atrybut pomaga badaczom odkrywać fenotypy, które w przeciwnym razie pozostałyby niezauważone.
Organy pochodzące od pacjentów, które zostały wygenerowane na płytkach Millicell® Microwell, okazały się ściśle modelować odpowiadający im guz i mogą być wykorzystywane przez naukowców do badania specyficznych dla pacjenta odpowiedzi na chemioterapie.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?