PEG構造を基盤としたヒドロゲルを用いたパターニング-空間的複雑さの設計
組織工学用に開発された生体材料の足場の多くは比較的均一であり、in vivoの細胞微小環境の持つ複雑さや組織構造を備えていません。これらの均一な足場によって、微小環境に対する細胞応答の理解が大きく進みましたが、生体材料の性質とその生物学的機能に与える影響の間の動的な関係を明らかにするには、空間的かつ時間的により複雑な足場が必要であると思われます。そこで、空間的、時間的いずれにおいても、生化学的および生体力学的な信号の表示を制御できるような、さまざまなパターニング方法が開発されてきました。3Dマトリックスの性質が動的に変化することに対する細胞応答を明らかにするには、細胞を生きたままで足場を変化させなければなりません。したがって、シリコンやガラスの基板に応用されているパターニング技術の多くは、そのままではこれらの用途に利用することができません。細胞存在下で応用可能ないくつかの2Dおよび3D足場パターン形成技術の利点と制約について紹介します。今回はポリ(エチレングリコール)(PEG)ベースのヒドロゲルに関する方法について説明しますが、技術的には光学的に透明な光活性を持つどのような物質に対しても応用が可能です。
ヒドロゲルは、これまで複雑なデバイスの作製、薬物放出、および組織工学に広く利用されている生体材料足場として有用です。特に、PEG構造を基盤としたヒドロゲルは、組織工学用途に極めて汎用的であることが実証されています。PEGはさまざまな用途に対してFDA認証を受けており、高い生体適合性を持ち、かつ免疫原性をほぼ(まったく)示しません。さらに、軟部組織の再生に適した範囲で、PEG構造を基盤としたヒドロゲルは調節可能な機械的性質を持っています。パターニングに用いる際に重要な点として、PEG構造を基盤としたヒドロゲルは本質的にたんぱく質吸着と細胞接着に対する耐性を持つため、希望する生体機能性を構築するための生物学的な「白紙状態(blank slate)」が得られることが挙げられます1。PEGヒドロゲルを合成するには、2つ以上の架橋可能な官能基(たとえば、アクリル基)を持つ各PEG鎖を水溶液に溶解し、適切な光重合開始剤(たとえば、2,2-dimethoxy-2-phenylacetophenone)と混合したのち、紫外光または可視光を照射します2,3。アクリル基がフリーラジカル重合によって架橋し、不溶性のヒドロゲル網目構造が生成します。この重合反応には、光重合開始剤および光源の強度に応じた1~10分間の光照射が必要で、細胞が生存可能な穏やかな条件下で行うことができます。重合反応は迅速に進みますが、酸素や他のフリーラジカルによる効果的な停止反応によって光誘起重合の空間的局在性が保たれると考えられています。これは、精密なパターン形成には不可欠な特性です。PEG構造を基盤としたヒドロゲルのパターニングは、大きく2つの方法に分けることができます。1つは、複雑な形状を持つヒドロゲル網目構造の作製に重点を置いたものです。もう1つは、既存の(あらかじめ形成された)多くの細胞を含むヒドロゲル構造体の、空間的および時間的な改質に重点を置いたものです4-16。このレビューで注目する後者の手法の開発は、細胞機能と複雑な組織再生における生体力学的信号と生化学的信号の空間的および時間的役割を理解するのに特に重要です。以下の議論の中で、「2Dパターニング」という用語は、x-y方向には変化するがz方向は一様なパターンの形成を指し、「3Dパターニング」は、x、y、およびz方向に変化するパターンの生成を指します。言い換えると、これらの用語は、パターニングされた物質の次元ではなく、パターンの空間的変化の次元を表します。
2次元パターニングの方法
透明性を利用したフォトリソグラフィーは、2Dの生化学的および生体力学的パターンを既存のヒドロゲル構造体中に作製する1つの方法です。1つの具体例として、PEG-diacrylate(PEGDA)からヒドロゲルを調製しました。この際、その後の反応に利用できる十分な量の遊離アクリル基が残るようにしました10。次に、パターニングに用いられるアクリラート成分をこれらの「不完全に」重合したゲルの表面に塗布し、透明なフォトマスクをヒドロゲル表面に直接接触するように置きました。フォトマスクを通してヒドロゲルに光照射することで、モノアクリラート成分が、ヒドロゲル表面のマスクの光透過部分に対応する領域に共有結合で固定化されます。このモノアクリラート細胞接着性成分をパターニングすることにより、パターニングされていない領域は生体不活性のまま、細胞-材料間の相互作用を持つ特定領域を定義できます(図1)。この方法を順次適用することによって、複数の細胞接着性ペプチドをヒドロゲルの表面上に容易にパターニングすることが可能です10,15。

図1透明性を利用したパターニング。(a)透明性を利用したフォトリソグラフィーにより既存のREGDAヒドロゲル網目構造の表面上に形成した、蛍光標識されたモノアクリラート誘導体化細胞接着性ペプチドArg-Gly-Asp-Ser(RGDS)のパターン。(b)関連するヒト皮膚線維芽細胞の表面接着。パターニングされていない領域が生体不活性のまま残っていることがわかります。
Westらが示したとおり、アクリラート種が照射前にヒドロゲル網目構造内に拡散できるようにすれば、得られるパターンはゲルの層全体にわたって広がり、ヒドロゲル内部での細胞の挙動を制御するのに利用できます(図2)11。さらに、パターニングに用いる物質が2つ以上のアクリル基で官能化されていれば、ヒドロゲルの生体力学的性質を局所的に変化させることができます11。
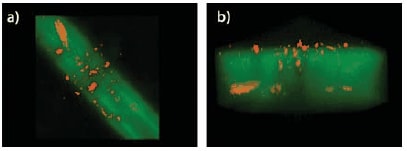
図2蛍光標識されたモノアクリラート誘導体化RGDSによる、透明性を利用したフォトリソグラフィーを用いてパターニングしたチャネル内に限定された細胞移動。これらのパターニングされたチャネルは、あらかじめ作製したコラゲナーゼ分解性PEGDAヒドロゲルの中に形成されたものです。パターニングされたヒドロゲル(アクリラート誘導体化RGDS(緑色)およびクラスター状HT-1080細胞(赤橙色))の共焦点顕微鏡画像(zスタック)をOsiriX3Dボリュームレンダリング処理した(a)上面図、および(b)側面図。(b)に見られるRGDS強度の見かけ上の不均一さは、実際に強度が不均一であるためではなく、主に画像処理によって生じたものです。
物理的なフォトマスクを使用する方法とは対照的に、標準的な共焦点顕微鏡のレーザースキャニング機能を使用して、ヒドロゲルの2D表面パターンを作製することができます9。透明性を利用したヒドロゲルのパターニング方法と同様に、あらかじめ作製された不完全に重合したPEGDAヒドロゲルの表面にアクリラート種を塗布します。レーザースキャンとレーザーシャッターをコンピュータ制御すると、いわゆる「仮想マスク」が得られてヒドロゲル表面の希望する領域にのみレーザー光が照射されます。Westらが示したように、ヒドロゲル表面に結合するアクリラート種の量は、レーザー強度またはスキャン速度を調節して空間的に制御でき、複雑な2Dの濃度勾配を得ることができます(図3a)9。従来のフォトリソグラフィー用マスクを使用した場合には、このような照射量による空間制御を行うことは容易ではありません。連続的な照射サイクルの間に洗浄ステップを組み込むことによって、複数の生物活性ペプチドをヒドロゲル表面にパターニングすることが可能です9。さらに、集束レーザービームの代わりに局所レーザービームを使用すると、適度な厚みをもつ足場全体に均一な断面パターンを形成できます5。

図3標準的なレーザースキャニングリソグラフィーと2光子レーザースキャニングリソグラフィー。(a)標準的な共焦点顕微鏡の「仮想マスク」機能を使用して、既存のPEGDAヒドロゲル網状構造の表面に形成した、蛍光標識されたモノアクリラート誘導体化細胞接着性ペプチドRGDSのグラデーションパターン。(b)2光子レーザーを備えた共焦点顕微鏡を使用して、蛍光標識されたアクリラート誘導体化RGDS(白色)でパターニングされた、ヒドロゲルの共焦点顕微鏡画像(zスタック)のOsiriX 3Dボリュームレンダリング処理した側面図。
3次元パターニングの方法
上に述べた方法は、垂直方向に均一なパターンの作製に限られます。あらかじめ作製したヒドロゲルの中に、天然組織を模倣した空間的に複雑なパターンを実現するために、2光子励起過程を用いたパターニングが研究されています。2光子吸収の現象を利用して、3D蛍光イメージングや3Dリソグラフィーによる微細加工の開発が可能です。これらの方法はいずれも、励起ビームを細く絞ることによって、2光子吸収領域を励起光波長のおよそ半分の焦点領域に限定できることを利用しています。ラジカル拡散の時間スケールがラジカルの半減期と比較して長いために、光開始ラジカル重合などのその後の反応もこの狭い領域内に限定されます。その結果、2光子レーザービームの焦点の位置を指定することにより、光誘起による結合領域を正確に決定できます。これは、光誘起結合が焦点面の外側で生じる「標準」レーザーと異なる点です。多光子レーザーモジュールは、現在市販されているほとんどの共焦点顕微鏡で利用可能であり、これら機器に付属している、レーザースキャンとレーザーシャッターの機能を用いて2光子パターニングを容易に行うことができます。
既存のヒドロゲル網目構造の中に3Dパターンを作製するには、重合が不完全なPEGDAヒドロゲルを再度調製し、アクリラート成分をゲル網目構造の中に拡散させた後、ヒドロゲルを共焦点顕微鏡のステージ上に置き、2光子レーザースキャニングを開始します。2光子パターニングサイクル中に照射時間またはビーム強度を変えることにより、改質の度合を空間的に調整できます11,16。重合後、不均一に分布したパターニング分子を露出させるために、残った前駆体物質をヒドロゲルから外部に拡散させます(図3b)11。
化学反応の拡張
上述のPEDGAヒドロゲルの2Dおよび3Dパターニング方法は、PEGヒドロゲルの生成とゲル網目構造への各種化学種の結合の両方に同じ化学反応を使用しています。ところが、この方法ではパターニングプロセス自体によって最初のゲル構造が変化し、網目構造の改質度は、未反応のアクリル基がどの程度利用できるかによって制限されます。さらに、希望する生物活性部分を必要に応じて追加できますが、生物活性信号を直ちに除去することはできません。これらの制約に対処するために、Ansethらは、ヒドロゲルの物理的性質と化学的性質を独立して制御できる、明確に定義された架橋ヒドロゲルの合成が可能な手法を開発しました12-14。この方法は基本的に「オルトゴナル化学(orthogonal chemistry)」を利用しており、1つの化学反応をヒドロゲル網目構造の生成に使用し、2番目の化学反応を生物活性要素のパターニングに使用します。to pattern in bioactive factors.さらに、光解離性結合をヒドロゲル網目構造内に導入することによって、追加した生物活性信号をいつでも除去することが可能です14。上に述べた2Dと3Dのパターニング方法を組み合わせると、生体材料の性質とその生物学的機能に与える影響との間の動的な関係を制御した状態で研究できます。これらのパターニングされた足場を使用した研究によって、細胞の挙動に関する理解が進み、再生医学用途向け足場材料の性質を合理的に設計できるようになると考えられます。
謝辞
パターニングされたゲル中の細胞移動の画像(図2)のほか、共焦点レーザースキャニングパターンや2光子レーザースキャニングパターンの画像またはレンダリング処理画像(図3)を提供していただいたJennifer West博士に感謝します。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?