炭化ケイ素―The return of an Old Friend―
Nicholas G. Wright, Alton B. Horsfall
School of Electrical, Electronic and Computer Engineering Newcastle University Newcastle upon Tyne, UK
Material Matters Volume 4 Article 2
近年、炭化ケイ素(SiC)が、多くの材料および工学的用途に不可欠な物質として再び注目を集めています。興味深いことに、SiCは人工的に合成された後で自然界で発見された数少ない鉱物の1つです。最初に合成されたのは1891年で、Edward Achesonが炭素とアルミナを電気的に加熱した溶融液の中に小さな黒色結晶のSiCを偶然に発見しました1。その後、この方法が改良され(いわゆるアチソン法)、工業用研磨剤として使用される微細なSiC結晶(粉末状に粉砕したもの)が商業的に大量生産されるようになりました2。天然の炭化ケイ素が見つかったのは1905年で、ノーベル賞を受賞した化学者Henri Moissanによって、アリゾナ州ディアブロ渓谷にて発見されました。現在モアッサナイト(moissanite)と呼ばれるこの透明な鉱物は、ダイアモンドとほとんど同じ輝きと硬さを持つため、宝石用原石として多くの場合使用されます。今日までSiCの大規模な天然鉱床は発見されていないため、現在使用されているSiCはすべて合成されたものです。
今日、SiCは航空宇宙、エレクトロニクス、工業用炉、耐摩耗性機械部品などの産業で重要な役割を果たす、最も幅広く使用されている材料の1つです。SiCはエレクトロニクスやその他のハイテク用途に広く使用されていますが、量的観点からは冶金、研磨剤、および耐火物工業で多く使用されています。
結晶構造
炭化ケイ素は層状の結晶構造を持ち、多くの異なる形態すなわちポリタイプがあります。そして等量の炭素とケイ素からなり、各原子はそれぞれ反対の種類の4つの原子と四面体配置で結合しています。SiC結晶の層にはA、B、およびCの3つの可能な原子配置があり、どのポリタイプも同じ種類の層を含みますが積層順序が異なります(図1参照)3。炭化ケイ素は、ある1つの層をさまざまな向きでもう1つの層の上に積層できる(横方向の移動と回転がエネルギー的に可能)ために多種多様な積層順序が可能であり、それぞれ特有の積層順序によって異なるポリタイプが生成されます(たとえば、立方晶、六方晶、菱面体晶のいずれの構造も生じる可能性があります)。α型(非立方晶)と呼ばれる六方晶と菱面体晶構造は結晶化して多数のポリタイプを形成する一方、立方晶構造(β型と名付けられている)では今日まで1つの形しか見つかっていません。さらに、積層順序内の層の数の後にH、R、またはCを付けて4、その形が六方晶、菱面体晶、または立方晶のどの構造に属するかを示します。今までに215種類を超えるポリタイプが見つかっていますが、技術的に重要なもの(主として、4Hと6Hの六方晶および3Cの立方晶形)は限られた種類になります5。その理由としては、これらのポリタイプが商業的に入手可能であることと、移動度の異方性(結晶学的方向によるキャリア移動度の違い)が小さいことが挙げられます。
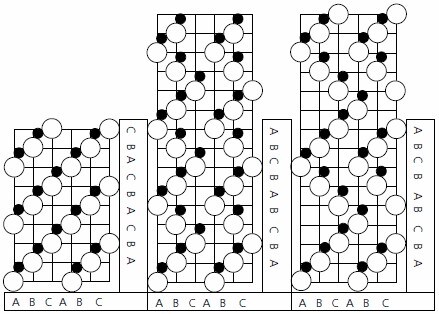
図1(a)3C SiC、(b)4H SiC、および(c)6H SiCの結晶構造の積層順序
「炭化ケイ素」という用語の意味することは、実際にはさまざまです。たとえば、機械技術者は「各種結合剤で結合した比較的低純度のSiC微結晶に、温度と圧力の両方またはそのどちらかを加えて作製されたセラミックス」を表すためにこの単語を使い、一方、電気技術者は「高純度SiC単結晶ウエハ」を考えるかもしれません。
機械的特性に基づく用途
どのような結晶構造の炭化ケイ素も、モース硬度が9のアルミナと10のダイアモンドの間に位置する硬質材料としてよく知られています6。炭化ケイ素は熱伝導率が高く熱膨張が小さいため、他の耐熱材料と比較して非常に高い熱衝撃抵抗を備えています6。エレクトロニクス分野での応用例が見つかるまで、商業的に重要であったのはSiCセラミックスの機械的特性でした。
各種セラミック製品を製造するにあたって、まずSiC粉末の合成が基本的に必要であり、合成した粉末を成形することによりセラミック製品が得られます。さまざまな純度、結晶構造、粒子サイズ、形状、および粒径分布を持ったSiC粉末を、いくつかの合成方法で調製することができます。たとえば、昇華炭素還元(熱炭素還元、アチソン法)、有機ケイ素ポリマーからの熱変換、気相化学反応などがあります。
炭化ケイ素セラミックスは本来脆いものですが、多くの機械用途で回転部品や静止部品の代表的な材料として使用されています。炭化ケイ素セラミックスの特性は、金属と比較して破壊靱性や限界破壊ひずみが低いという点にあります。一般に炭化ケイ素セラミックス部品の強度は、原材料に存在する欠陥によって決まります。欠陥の種類、サイズ、形状、および位置は極めてさまざまであり、従って強度もさまざまです。異なる方法で作製された炭化ケイ素セラミックスは、機械的性質も大きく異なります。たとえば、焼結炭化ケイ素は高温で強度を維持し、時間に依存する性質であるクリープや亀裂成長に対して高い耐性を示します。これとは対照的に、反応焼結SiCは微細構造中に遊離ケイ素が存在するため、高温特性はやや劣ります7。
炭化ケイ素は極めて硬いことから、ブレーキライニングや電気接点など耐摩耗性が重要である場合のコーティング材として使用され、また一方、床や階段の踏み板、テラゾータイル、デッキ用塗料、路面などの滑り止め用途にも使用されます。SiCはまた、高い腐食性環境をはじめとするさまざまな厳しい環境で、ポンプ、圧縮機、および攪拌機のメカニカルシーリングに使用されます。炭化ケイ素は、酸化アルミニウムなどの他の研磨材より脆くはありますが硬い材料です。炭化ケイ素研磨材は粒子が砕けやすく鋭い切削作用が保たれるため、通常、チルド鋳鉄、大理石、御影石などの硬くて引張り強度の低い材料や、繊維、ゴム、皮革、銅などの鋭い切削作用が必要な材料の研削に使用されます。炭化ケイ素は粉末の形でラッピング用(砥粒)に、また、他の材料と混合することで研磨ペーストになります。もしくは、布を裏当て材とすることで研磨シート、ディスク、ベルトとしても利用されます6。
電子的および光学的特性に基づく用途
近年、SiCがエレクトロニクス向けの有望な材料として注目されています8,9。ポリタイプによってバンドギャップが異なり、その範囲は2.4 eV~3.3 eV であるため(ケイ素のバンドギャップは1.1 eV)、ワイドバンドギャップ材料と見なされます10。特に、ポリタイプの結晶構造における積層順序の点以外では同じ二重層であるにもかかわらず(図1参照)、このようにバンドギャップに大きな幅があるのは注目すべき点です。近年の研究によって、炭化ケイ素の材料特性がエレクトロニクス用途、特にパワーエレクトロニクスとセンサー用に利用可能となりました11。さらに、発光ダイオードの基板材料としても広く使用され、光学活性層を成長させる基礎としての役割を果たしています。これは6H SiCと窒化ガリウムの格子定数が近いことを利用したもので、さらにSiCの高い熱伝導率を利用してLED内部で発生した熱の除去も可能になります。
炭化ケイ素の重要なアプリケーションの1つに、ガスセンサーがあります12。炭化ケイ素はバンドギャップが広いために真性キャリア濃度が非常に低く、内燃機関から放出される汚染物質や噴火口からの硫黄を含む排出物など、非常に高温のガスを検知できます。代表的な炭化ケイ素ガスセンサーは直径約100 μm、厚さ数分の1ミリメートルで、一般に図2に示すような触媒電極を持つコンデンサー(MIS構造)になっています13。このようなデバイスは、誘電体層を金属と炭化ケイ素で挟む構造をとることで、900℃を超える温度での動作が可能です14。この誘電体層は、一般にTiO2やHfO2などの金属酸化物材料ですが、これらは金属層のin-situ酸化、もしくは前駆体物質を用いた原子層堆積法などのより高度な製法をはじめとする、さまざまな方法で作製することができます15。金属表面がガス混合物にさらされるとガス分子の分解が加速し、イオンが放出されてデバイスの電気特性が変化します。水素および水素を含む分子の場合、150℃を超える温度であればミリ秒未満の時間スケールにて、ガス分子が分解した後に水素原子は厚みのあるもしくは高密度の触媒電極を容易に拡散し、荷電層が形成されます16。センサーの応答は、静電容量シフト、静電容量を維持するために必要な電圧シフト、酸化物(誘電体層)のリーク電流など、多くの方法で測定できます。自動車の排気系統のマニホールド部分に近い場所など、周囲の環境条件が急激に変化する場合、従来のセラミックセンサーが応答に10秒程度を要するのに対し18、炭化ケイ素センサーは電気的応答速度が速いため、このような環境でのガス種の検知に適しています17。

図2SiCガスセンサーの断面図SiCガスセンサーの断面図。SiO2層は、その大きなバンドオフセットにより高い動作温度でのリーク電流を低減するため、およびSiC/SiO2界面の欠陥密度を下げるために使用されます(図は、許可を得て参考文献14©2007 IEEEから転載)。通常、SiCは高濃度に窒素ドープした厚さ350 μmの基板と低濃度にドープした厚さ数μmのエピ層で構成されます。
ガス混合物の組成を決定するためにそれぞれのガスの影響を分離することは容易ではありません。600℃を超える温度では、ガス種が金属表面で完全に分解するため、個々のガスを特定することは不可能になります。たとえば、メタンとエタンの分子が完全に分解すると、それぞれ4個と6個の水素イオンが発生します。すなわち、ある濃度のメタンとその2/3の濃度のエタンは同じ数の水素イオンを発生するため、これらを識別することはできません。150℃未満の温度では触媒表面でガス種が解離しないため、センサーはガスに全く反応しません。150℃~600℃ではガス種が部分的に分解するため、存在するガスを一意に識別するそれぞれ特性の異なるセンサーアレイを用いることができます。たとえば、パラジウムは水素に対して感度が高く、白金はアンモニアに対して感度が高いため、それぞれの金属を付けたセンサーを1つずつ使用してこれらのガスを識別できます。次に、「ガウス混合モデル」や「主成分分析」などのコンピューターアルゴリズムを使用して、測定されたデバイスの電気的応答を個々のガスについて分解します。この結果、さまざまなガスに対するこれらデバイスの感度は温度によって変化しますが、(すべてのセンサーに対して)校正を行うことによって正確で再現性のある測定値を得ることができます(図3参照)。

図3代表的なSiCガスセンサーの感度の温度変化(図は、許可を得て参考文献14©2007 IEEEから転載)
結論
炭化ケイ素は、近年、機械的用途だけでなくエレクトロニクス用および光学用材料としても技術的に不可欠な材料として注目されています。その優れた材料特性と基礎となる材料作製方法の確立によって、多くの分野で炭化ケイ素が応用されることが期待されています。
Network error: Failed to fetch
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?