金ナノ粒子へのタンパク質コンジュゲーション
Benny Pacheco
Cytodiagnostics, 919 Fraser Drive, Unit 11, Burlington, ON L7L 4X8, Canada
Nanomaterial Bioconjugation Techniques(ナノ粒子表面修飾ガイドブック), 2017, p.26

はじめに
金ナノ粒子コンジュゲートは他にない特有の光学的性質を示すことから、多くの用途で理想的な試薬であり、表面増強ラマン分光法(SERS:Surface Enhanced Raman Spectroscopy)プローブ、miRNAを局所的に腫瘍へ送達するための担体、およびがん特異的T細胞のin vivo追跡などに使用されています1-3。最も成果が得られている金ナノ粒子の用途は、ラテラルフローイムノアッセイにおける使用です。ラテラルフローアッセイは迅速かつ経済的な方法であり、急速に拡大しつつあるポイントオブケア検査などの用途に良く適しています4。
金ナノ粒子に抗体、タンパク質、または酵素などのリガンドをコンジュゲーションする方法として最も多く使用されているのは、受動的な吸着と共有結合による結合の2種類の方法です。受動的吸着法は最も簡便な手法であり、標準的なコンジュゲーション法として知られています。この方法では、標準的なクエン酸被覆金ナノ粒子を使用して、予め最適化した条件(pHおよびタンパク質濃度)の下でリガンドと混合します。その結果、静電相互作用の組み合わせやタンパク質に含まれる高い親和性を持つフリーのチオール基を介して、抗体、タンパク質、または酵素が金表面に「受動的」に結合します。受動的吸着法は非常にコスト効率の高い方法ですが、以下に示すような幾つかの欠点があります。まず、タンパク質は時間経過とともに金表面から脱離します。また、コンジュゲーションしたタンパク質の三次構造の乱れや5,6、活性に必要なたんぱく質立体構造の変化が悪影響を受ける可能性、抗原の結合サイトや活性サイトの遮蔽などにより、活性が失われる場合があります。
共有結合によるコンジュゲーションでは受動的吸着法の欠点の多くが解消されるため、非常に優れた代替方法となります。ただし、共有結合を作るためには、目的のリガンドを結合できる官能基(N-ヒドロキシスクシンイミド(NHS)エステル基やマレイミド基など)で金ナノ粒子表面を修飾する必要があります。本稿では、NHS基およびマレイミド基で活性化した金ナノ粒子の双方について、抗体をコンジュゲーションさせるためのプロトコルについて概説します。また、カルボキシル化金ナノ粒子をEDC/NHSで化学的に活性化する手順についても紹介します。
これらの方法では、受動的吸着と共有結合によるコンジュゲーション反応の双方で、分子が高密度で結合した理想的な金コンジュゲートが得られ、抗体コンジュゲートへの抗原の結合や酵素コンジュゲートの場合は酵素活性など、リガンドの機能的な形態は維持されます。リガンドの結合を確認するためだけではなく、その先の用途において確実に最適な性能を得るためにも、得られたコンジュゲートの機能性評価は重要となります。例えば、標準的なドットブロット法で抗体を評価することができます。
方法例Ⅰ:受動的吸着法による未修飾金ナノ粒子への抗体のコンジュゲーション
ここでは、修飾されていないクエン酸被覆金ナノ粒子(「標準金ナノ粒子」)に対して、受動的吸着法で標準的なIgG抗体を結合する手順を説明します。この方法は迅速かつ経済的で、結合力の強い抗体-金コンジュゲートが得られます。
以下に示す手順では、静電的相互作用を介して金表面に十分な量の抗体を受動的に強く吸着させて金表面を飽和させるための最適条件を、pHと抗体濃度の滴定により短時間で特定します。通常、コンジュゲーションに最適なpHは吸着させるタンパク質の等電点に近いか若干高く、タンパク質の総電荷がゼロまたはわずかに負となるpHです7。
材料
- コンジュゲーション用抗体:0.5×リン酸緩衝食塩水(pH 7.4)中に5~10 mg/mL
注記:効果的なコンジュゲーションのためには、タンパク質の純度を考慮する必要があります。ウシ血清アルブミン(BSA)などのタンパク質が混入しているとコンジュゲーションの際に抗体と競合するため、コンジュゲーション効率やその先の用途におけるコンジュゲートの性能が大幅に低下する場合があります。 - 5~100 nmの修飾されていないクエン酸被覆金ナノ粒子(OD=1)(「クエン酸安定化金ナノ粒子」製品リスト)
- 10% NaCl
- タンパク質希釈バッファー:0.5×リン酸緩衝食塩水(pH 7.4)(P5493)
- 10% BSA(w/v)
- コンジュゲート貯蔵バッファー:20 mM Tris(pH 8.0)、150 mM NaCl、1% BSA(w/v)
- コンジュゲーションバッファー:
- 0.1 Mリン酸ナトリウム(pH 5.7)
- 0.1 Mリン酸ナトリウム(pH 6.2)
- 0.1 Mリン酸ナトリウム(pH 6.5)
- 0.1 Mリン酸ナトリウム(pH 7.0)
- 0.1 Mリン酸ナトリウム(pH 7.4)
- 0.1 Mリン酸ナトリウム(pH 7.8)
- 0.1 Mホウ酸(pH 8.2)
- 0.1 Mホウ酸(pH 8.7)
- 0.1 Mリン酸ナトリウム(pH 9.0)
- 0.1 M炭酸カリウム(pH 9.2)
- 0.1 M炭酸カリウム(pH 9.4)
- 0.1 M炭酸カリウム(pH 9.8)
コンジュゲーション最適化のプロトコル
- タンパク質希釈バッファーを使用して一連のタンパク質希釈溶液を調製します(n=7)。多くのタンパク質に適切な最初の範囲は0.15~4 mg/mLです(表1を参照)。
- 表1のような表を用いて、96ウェルプレートの列1~12に対応する各ウェルに、上記のコンジュゲーションバッファー1~12の原液を4 μL加えます。
- 各ウェルに、金ナノ粒子溶液を100 μL加えます。ピペットで数回出し入れしてよく混合します。
- 手順1で調製した個々の希釈タンパク質溶液からそれぞれ2 μLを、表1の例に従って対応するウェル(行A~H)に移します。ピペットで数回出し入れしてよく混合します。
- 15分間室温でインキュベートします。
- 行B~Hの各ウェルに10% NaClを100 μL加えます(行Aのウェルは各pHの対照ウェルとします)。
- 15分間室温でインキュベートします。
- プレートリーダーを使用して530 nmと690 nmの吸光度を読み取ります。
- 次式に示すように各ウェルについて690 nmの吸光度と530 nmの吸光度の比を計算して、試料ウェル(行B~H)と対照ウェル(行A)との間の最終的な変化を特定します。
Ratio=(Abs@690sample/Abs@530sample)-(Abs@690control/Abs@530control) - NaClを加えた際に著しい凝集が起こらなかった試料のpHおよびタンパク質濃度が最適な条件となります。
凝集が起こると690 nmの吸収が増加し、530 nmの吸光度が減少します。したがって、試料(例:ウェルD5)とそれに対応する対照ウェル(例:ウェルD1)との間でこの690 nm/530 nmの比の最終的な変化がゼロに近い場合が最適なコンジュゲーション条件を与えます。計算した最終的な変化を図1Bのようにプロットすると、コンジュゲーションに最適な条件を簡単に見い出すことができます。
また、最適なコンジュゲーションが得られている試料では対照と比較して色の大きな変化が見られないため、単に裸眼でプレートを観察するだけでも最適の条件を決定することができます。逆に条件が最適ではない場合は、金ナノ粒子が青/紫色に変色したり、完全に色が失われたりします(図1A)。
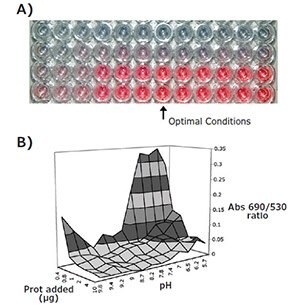
図1NaClを添加(方法例Ⅰの手順6)した後に得られる典型的な結果。A)で見られるように色の変化が観察されないウェルが最適な条件を示します。より詳細には、B)において試料と対照の690 nm/530 nmの比の最終的な変化がゼロに近いウェルが最適な条件を与えます。
コンジュゲーション反応のプロトコル(10 mL反応)
- 対応するpHのコンジュゲーションバッファーを400 μL加えて、10 mLの金ナノ粒子溶液のpHを上記の最適化手順で決定されたように調節し、よく混合します。
- pHを調節した金ナノ粒子溶液を、上記の最適化手順で決定された濃度のタンパク質希釈バッファー中の抗体200 μLに加えます。
- 混合しながら30分間室温でインキュベートします。
- 10% BSAを0.5 mL加えてよく混合します。
- コンジュゲートを1.5 mLのマイクロ遠心チューブに移し、金ナノ粒子のサイズに対して適切な速度で遠心分離します(表2を参照)。
- 上清を慎重に除去して廃棄します。
- 金コンジュゲートのペレットを総体積1 mLのコンジュゲート貯蔵バッファーに再懸濁させます。
- UV/Vis分光光度計で光学密度を測定し、目的の濃度に調節します。
- 使用するまで2~8℃で保管します。
方法例Ⅱ:カルボキシル化金ナノ粒子への抗体のコンジュゲーション
このプロトコル例では、カルボキシ基を一級アミン反応性N-ヒドロキシスクシンイミド(NHS)エステルに変換する中間活性化ステップを介した標準的な全長IgG抗体とカルボキシル化金ナノ粒子の共有結合性カップリングについて説明します。
材料
- コンジュゲーションさせる抗体:1×リン酸緩衝食塩水(PBS)(pH 7.4)中に0.5~5 mg/mL(表3を参照)
注記:効果的なコンジュゲーションのためには、タンパク質の純度を考慮する必要があります。一級アミンを含有する他の分子(例:TRIS)や他のタンパク質(例:BSA)が混入していると、コンジュゲーションさせるタンパク質と競合してコンジュゲーション効率が大幅に低下します。 - 5~100 nmのカルボキシル化金ナノ粒子(OD=50)(「官能基・PEG化金ナノ粒子」製品リスト)
- 活性化バッファー:10 mM 2-(N-モルホリノ)エタンスルホン酸(MES)(pH 5.5)
- カップリングバッファー:1×リン酸緩衝食塩水(PBS)(pH 7.4)(P5493)
- 洗浄バッファー:1×リン酸緩衝食塩水(PBS)(pH 7.4)、0.05% TWEEN® 20(w/v)
- コンジュゲート貯蔵バッファー:20 mM Tris(pH 8.0)、150 mM NaCl、1% BSA(w/v)
- 1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド塩酸塩(EDC)(E1769)
- N-ヒドロキシスクシンイミド(Sulfo-NHS)(56485)
NHS活性化のプロトコル
- 60 mgのEDCを500 μLの活性化バッファーに溶解します。
- 72 mgのSulfo-NHSを500 μLの活性化バッファーに溶解します。
- EDC溶液とSulfo-NHS溶液を混合します(EDCと Sulfo-NHSの最終濃度はそれぞれ30 mg/mlと36 mg/mL)。
- カルボキシル化金ナノ粒子10 μLをマイクロ遠心チューブ内に移します。
- 手順3で調製したEDC/NHS溶液の10 μLをカルボキシル化金ナノ粒子に加えます。
- 30分間室温でインキュベートします。
- 洗浄バッファー1 mLを加えてよく混合します。
- 処理中の金ナノ粒子のサイズに対して適切な速度でバイアルを遠心分離にかけます(表2を参照)。
- 上清を除去し、直ちにタンパク質のコンジュゲーションを行います(コンジュゲーションのプロトコルは下記を参照)。
コンジュゲーションのプロトコル
- 抗体溶液10 μLを、上記の手順で調製した活性化された金ナノ粒子に加えてよく混合します。
注記:金ナノ粒子を再溶解させるために、このステップで超音波処理が有効な場合があります。 - 2時間室温でインキュベートします。
- 洗浄バッファー1 mLを加えてよく混合します。
- 処理中の金ナノ粒子のサイズに対して適切な速度でバイアルを遠心分離にかけます(表2を参照)。
- 上清を除去します。
- ペレットを50 μLのコンジュゲート貯蔵バッファーに再懸濁させます。
- UV/Vis分光光度計で光学密度を測定し、コンジュゲート貯蔵バッファーを使用して目的の濃度に調節します。
- 金コンジュゲート溶液は、使用するまで2~8℃で保管します。
方法例Ⅲ:NHS活性化金ナノ粒子への抗体のコンジュゲーション
このプロトコル例では、標準的なIgG抗体とNHS-エステル活性化金ナノ粒子の共有結合性のカップリングについて説明します。本プロトコルは、一級アミンを含有する他の生体分子にも適用できます。
材料
- コンジュゲーションさせる抗体:1×リン酸緩衝食塩水(PBS)(pH 7.4)中に5~10 mg/mL
注記:効果的なコンジュゲーションのためには、タンパク質の純度を考慮する必要があります。一級アミンを含有する他の分子(例:TRIS)や他のタンパク質(例:BSA)が混入していると、コンジュゲーションさせるタンパク質と競合してコンジュゲーション効率が大幅に低下します。 - 5~100 nmのNHS活性化金ナノ粒子(2 mL、1 ODから凍結乾燥)(「金ナノ粒子コンジュゲーションキット(NHS / mareimide官能基化金ナノ粒子)」製品リスト)
- タンパク質再懸濁/反応バッファー:10~100 mMリン酸ナトリウム(pH 7.8)、150 mM NaCl
- クエンチャー:0.5 M Tris(pH 8.0)
- コンジュゲート貯蔵バッファー:20 mM Tris(pH 8.0)、150 mM NaCl、1% BSA(w/v)
コンジュゲーションのプロトコル
- 使用前にすべての試薬を室温に戻します。
- タンパク質再懸濁バッファーで抗体を希釈または溶解し、表3に示す最終濃度にします。
- マイクロ遠心チューブ内で、下の表に従って希釈したタンパク質試料と反応バッファーを混合します。
- 手順3で調製したタンパク質/反応バッファーの混合物90 μLを、凍結乾燥したNHS活性化金ナノ粒子が入っている1本のバイアルに移し、直ちにピペットで出し入れしてよく混合します。
注記:タンパク質を加える前に、凍結乾燥したNHS活性化金ナノ粒子をバッファーに再懸濁させないでください。NHSは水溶液中で急速に加水分解するため、コンジュゲーション効率が低下します。 - バイアルを1~2時間室温でインキュベートします。
- 10 μLのクエンチャー溶液をバイアルに加えて反応を停止させます。
- マイクロ遠心機を使用して、処理中の金ナノ粒子のサイズに対して適切な速度でバイアルを30分間遠心分離にかけます(表2を参照)。
- 未結合のタンパク質を含む上清を廃棄します。
- 100 μLの金コンジュゲート貯蔵バッファーをバイアルに加えて、コンジュゲートを再懸濁させます。
注記:用いたタンパク質に適した標準的な生物学的バッファーを使用してください。抗体-金コンジュゲートの場合、適切なバッファーは20 mM Tris(pH 8.0)、150 mM NaCl、1%(w/v)BSAです。 - 分光光度計でコンジュゲートのUV/Visスペクトルを記録し、光学密度が10になるように金コンジュゲート貯蔵バッファーで濃度を調節します。
- 得られたコンジュゲートの評価を実施します(ドットブロットやウェスタンブロットなど)。
- 金コンジュゲート溶液は、2~8℃で保管します。
方法例Ⅳ:マレイミド活性化金ナノ粒子への抗体のコンジュゲーション
このプロトコル例では、標準的なIgG抗体とマレイミド活性化金ナノ粒子の共有結合性カップリングについて説明します。本プロトコルは、チオール修飾アプタマーまたはオリゴヌクレオチドのようなチオールを含有する他の生体分子にも適用できます。
材料
- コンジュゲーションさせる抗体
注記:マレイミドはチオールと反応するため、タンパク質の種類によってはジスルフィド結合の還元や、生体分子へのチオール基の修飾があらかじめ必要になる場合があります。
コンジュゲーション効率の最適化には、DTTのようなチオールを含有する化合物やBSAなどが抗体溶液に混入しないようにしてください。 - 5~100 nmのマレイミド活性化金ナノ粒子(2 mL、1 ODから凍結乾燥)(「金ナノ粒子コンジュゲーションキット(NHS / mareimide官能基化金ナノ粒子)」製品リスト)
- タンパク質再懸濁バッファー:10~100 mMリン酸ナトリウム(pH 7.2)、150 mM NaCl
- 反応バッファー:10~100 mMリン酸ナトリウム(pH 7.2)、150 mM NaCl
- クエンチャー:10 mMグルタチオン
- コンジュゲート貯蔵バッファー:20 mM Tris(pH 8.0)、150 mM NaCl、1% BSA(w/v)
コンジュゲーションのプロトコル
- 使用前にすべての試薬を室温に戻します。
- タンパク質再懸濁バッファーで抗体を希釈または溶解し、表3に示す最終濃度にします。
- マイクロ遠心チューブ内で、下の表に従って希釈したタンパク質試料と反応バッファーを混合します。
- 手順3で調製したタンパク質/反応バッファーの混合物90 μLを、凍結乾燥したマレイミド活性化金ナノ粒子が入っている1本のバイアルに移し、直ちにピペットで出し入れしてよく混合します。
注記:タンパク質を加える前に、凍結乾燥したマレイミド活性化金ナノ粒子をバッファーに再懸濁させないでください。マレイミドは水溶液中で急速に加水分解するため、コンジュゲーション効率が低下します。 - バイアルを1~2時間室温でインキュベートします。
- 10 μLのクエンチャーをバイアルに加えて反応を停止させます。
- マイクロ遠心機を使用して、処理中の金ナノ粒子のサイズに対して適切な速度でバイアルを30分間遠心分離にかけます(表2を参照)。
- 未結合のタンパク質を含む上清を廃棄します。
- 100 μLの金コンジュゲート貯蔵バッファーをバイアルに加えて、コンジュゲートを再懸濁させます。
注記:用いたタンパク質に適した標準的な生物学的バッファーを使用してください。抗体-金コンジュゲートの場合、適切なバッファーは20 mM Tris(pH 8.0)、150 mM NaCl、1%(w/v)BSAです。 - 分光光度計でコンジュゲートのUV/Visスペクトルを記録し、光学密度が10になるように金コンジュゲート貯蔵バッファーで濃度を調節します。
- コンジュゲート溶液の評価を実施します(ドットブロットまたはウェスタンブロットなど)。
- 金コンジュゲート溶液は、2~8℃で保管します。
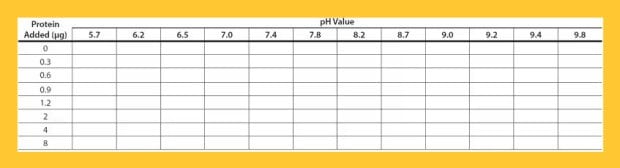
表1コンジュゲーション条件の探索に用いられる表(96ウェルプレート) – 方法例Ⅰ
掲載誌
「ナノ粒子表面修飾ガイドブック Nanomaterial Bioconjugation Techniques」
まとめてご覧になりたい方のためにPDFをご用意しています。
金ナノ粒子 コンジュゲーションキット
Maleimide functionalized(供給元製品紹介サイト)
NHS functionalized(供給元製品紹介サイト)
金ナノアーチン コンジュゲーションキット
Maleimide functionalized(供給元製品紹介サイト)
NHS ester functionalized(供給元製品紹介サイト)
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?