Barrier-képződési és áteresztőképességi vizsgálatok Millicell® függő sejtkultúra-betétekkel
Történet
- Barrier Assay áttekintés/a>
- Mire van szükségem a Lucifer Yellow Assay elvégzéséhez?
- Millicell® függő sejtkultúra betét kiválasztása
- TEER kimutatási módszer
- TEER alkalmazási jegyzetek, útmutatók és egyéb források
- Lucifer sárga barrier Assay minta protokoll
- Mintagát-barrier Assay mintaadatok
- Mintagát-barrier Assay mintaadatok
- Barrier Assay tippek és trükkök
- Kapcsolódó termékek
- Referenciák
Barrier Assay Overview
A sejtkultúra barrier assay-ket a barrier szövetek (vese, tüdő, bél stb.) modellezésére használják a gyógyszeradagolás, a gyógyszerfelszívódás, a sebgyógyulás, a bakteriális/vírusos fertőzések, a gyulladás és egyéb vizsgálatok során. Ezek a gátak in vitro képezhetők, amikor a hámsejteket egyetlen sejtszuszpenzióként vetik be, és addig nőnek együtt, amíg egyetlen szövetté nem olvadnak össze. Jellemzően ez a szövet egy hámsejt vastagságú, és hámmonorétegnek nevezik. A standard barrier vizsgálatokban a sejteket porózus membránokra ültetik, és noninvazív módon, transzepithelialis elektromos ellenállás (TEER) mérésekkel figyelik meg. A TEER-mérések validált, jelölésmentes és gyors technikák az epiteliális monoréteg barrier kialakulásának jelzésére a további értékelés és kísérletezés előtt. A gátképződést az ellenállás mérésének növekedésével lehet megfigyelni; a konfluens hámréteg magasabb ellenállási értékeknél plató lesz. A legtöbb gátvizsgálathoz az epiteliális monoréteg a kívánt típusú sejtgát, mivel ez modellezi a tüdő-vér, a vese szűrés vagy a bél felszívódás egysejtű vastagságát, és felhasználható a hámsejtek közötti paracelluláris tér elemzésére. Miután a sejtes gát integritását megerősítették, ezek a szövetek felhasználhatók olyan kísérletekben, amelyek a gát áteresztőképességét, megszakadását vagy erősségét vizsgálják.
A szoros kötés pórusai a paracelluláris transzport fiziológiai kapuőrei a hámszövetekben. A paracelluláris permeabilitási vizsgálatok a monoréteges gátképződést és a paracelluláris szoros átkötések szorosságát mérik egy adott idő alatt egy epitélsejt monorétegen áthaladó molekula mennyiségének mérésével. Ez a fajta vizsgálat élő sejteket igényel, és általában nem roncsoló jellegű (pl. Lucifer-sárga paracelluláris permeabilitási vizsgálat). A vizualizációra általában immunfestést és szöveti immuncitokémiát (ICC) használnak, megelőzve az elektronmikroszkópia szükségességét. Számos ilyen elemzés a festékként, gyógyszerkonjugátumokként vagy az átvitt célfehérje mennyiségeként követett gáton való áthaladásra összpontosít. Az alternatív elemzések a membrán vizualizálását olyan festékekkel, mint a kristályviola, fluoreszcens antitestfestés és ICC.
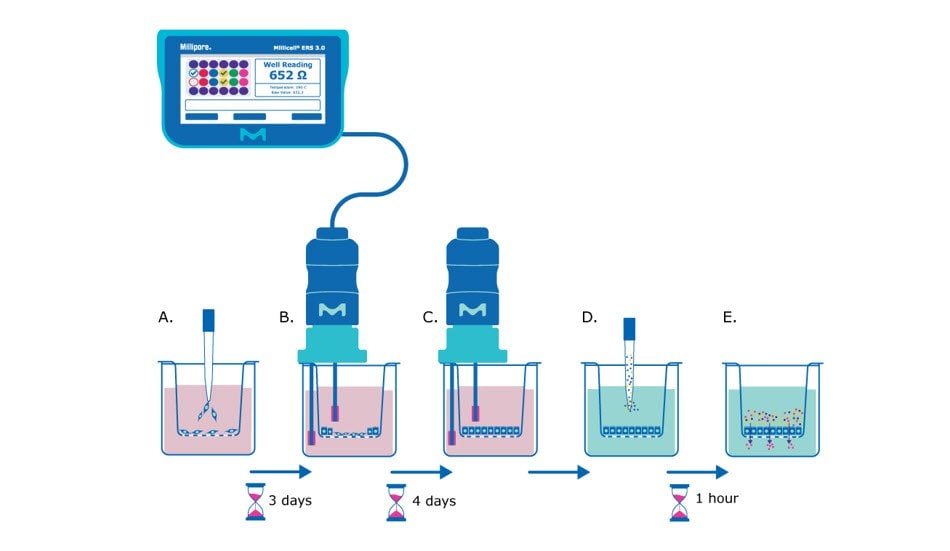
1. ábra. Barrier assay elve a Millicell® függő sejttenyésztő betétek használatával. A) A 0. napon a hámsejteket egysejtű szuszpenzióban a Millicell® függő sejtkultúra-betét membránjára vetjük. B) Néhány nap múlva (~3 nappal a beültetés után az MDCK sejtek esetében) a sejtek eléggé konfluensek lesznek ahhoz, hogy megkezdjük a TEER méréseket, és az ellenállás értéke alapján értékeljük a hámsejtek monorétegének kialakulását. C) A TEER-méréseket naponta vagy kétnaponta lehet végezni a monoréteges gátképződés nyomon követése érdekében, amíg a sejtek nem érnek el egy állandó ellenállási értéket (~7 nappal a beültetés után az MDCK sejtek esetében). D) Ekkor a tápfolyadékot kicseréljük barriervizsgálati folyadékra (Hank kiegyensúlyozott sóoldata), és a membrán apikális oldalára permeabilitásvizsgálati festéket/molekulát (pl. Lucifer sárga festék) adunk. E) A kismolekulákat 37°C-on inkubáljuk a hámmonolayerrel a protokoll ajánlott hosszáig (pl, 1 óra), majd a membránbetét bazolaterális oldaláról származó folyadékot kiértékeljük a kiválasztott molekula átjutásának mértékét.
Mire van szükségem a Lucifer-sárga gátvizsgálat elvégzéséhez?
- Millicell® függő sejttenyésztő betét 0,4 vagy 1 µm pórusmérettel (lásd alább a Millicell® függő sejttenyésztő betét kiválasztása című részt)
- Vevőlemez (CLS353046, CLS353043, CLS35303047)
- Lucifer sárga festék
- Hank kiegyensúlyozott sóoldata
- Millicell® ERS 3.0 Digitális Voltohmméter
- Mikrolemez olvasó
- 96-Well fekete/tiszta aljú mikrolemez
Millicell® függő sejttenyésztő betét kiválasztása
A függő betéteken barrierpróbákat végzünk, mivel a porózus membránok a standard polisztirol felületekhez képest lényegesen jobb tulajdonságokkal rendelkeznek az ún. 2.5D sejttenyésztésnek nevezik. Az ezekben a betétekben lévő membránok pórusméretükben különböznek, ami a különböző vizsgálati típusok esetében válik fontossá. Például a migrációs vizsgálatokhoz a kísérletben részt vevő sejttípus alapján a pórusméretek legszélesebb skálája áll rendelkezésre.
TEER kimutatási módszer
A Millicell® ERS 3.0 voltohmméter alacsony áramot és feszültséget használ, hogy lehetővé tegye a sejtkultúrákban a hámmonolayerek összefolyásának roncsolásmentes vizsgálatát. A TEER műszerek alacsony váltakozó áramot termelnek, amely elkerüli az elektródok fémlerakódásait és a szövetekre gyakorolt káros hatásokat, amelyeket egyébként a magasabb egyenáram okozhat. A sejtmonoréteg összefolyását a TEER-olvasókkal detektált szöveti ellenállás növekedése vagy platója alapján lehet meghatározni.
MDCK tenyészközeg
- Dulbecco MEM magas glükózzal
- 10% FBS
- 1% (1x) NEAA
- 1% Penicillin/streptomicin
- 4 mM L-glutamin
A sejtek beültetése 24 lyukú Millicell® függő sejttenyésztő betétre
- Kultúra MDCK sejteket, amíg 60-80%-ban összefolyóvá nem válnak.
- Légtelenítse a tápfolyadékot a tenyésztőlombikból.
- Adjon hozzá steril PBS-t 3 percig szobahőmérsékleten.
- Aspiráljuk ki a folyadékot a tenyésztőlombikból.
- Adjunk tripszint a tenyésztőlombikba, és inkubáljuk 37 °C-os, 5% CO2-os sejttenyésztő inkubátorban.
- Állítsa le a tripszinreakciót egyenlő részek teljes sejttenyésztő közeg hozzáadásával a lombikhoz.
- Vegye fel a folyékony szuszpenziót, és centrifugában 300 x g sebességgel forgassa le 3 percig.
- Rezuszpendálja a sejteket 1 ml teljes sejttenyésztő táptalajban (lásd a fenti MDCK tenyésztő táptalaj receptjét).
- Számolja meg a sejteket trypánkék és hemocitométer segítségével. Keverje össze a 90% tripan-kéket 10%-os sejtszuszpenzióval (pl, 180 µL trypan-kék és 20 µL sejtszuszpenzió).
- Számolja meg az élő sejteket a hemocitométeren, és számolja ki a sejtek milliliterenkénti számát.
- Adjon 900 µL teljes tápfolyadékot a 24 lyukú membránok bazolaterális oldalára.
- Rezuszpendálja a sejtszuszpenziót megfelelő térfogatban, hogy 200 µl szuszpenziót adagoljon a kívánt sejtbeültetési sűrűséggel (pl, 1250 sejt/betét, 2500 sejt/betét, 5000 sejt/betét).
- Tegye a 37 °C-os, 5% szén-dioxidos sejtkultúra inkubátorba, és minden második nap cserélje a táptalajt.
JEGYZET: A legjobb gyakorlat az, hogy a Millicell® függesztett sejttenyésztő betéthez és a befogadólemezhez való hozzáadás előtt a teljes sejttenyésztő közeget előmelegítse.
A sejtek ellenállóképességének mérése
- Hagyja, hogy a lemez elérje a szobahőmérsékletet (15-30 perc).
- Töltse be a tányértérképet, és rendelje a kutakat a Millicell® ERS 3.0 digitális feszültségmérőn csoportokhoz (lásd a felhasználói útmutató 11. oldalát).
- Tesztelje a Millicell® ERS 3.0 digitális feszültségmérőt a hitelesítési adapter segítségével (lásd a p. 22. részét a felhasználói útmutató).
- Állítsa a MODE kapcsolót Ohms állásba, és kapcsolja be a Power kapcsolót On.
- Az elektródát úgy fordítsa be, hogy a rövidebb hegy a Millicell® függő sejttenyésztő betét apikális oldalán, a hosszabb hegy pedig a külső mélyedésben legyen. A rövidebb hegy nem érintkezhet a membránon növő sejtekkel, a hosszabb hegy pedig éppen csak érintse a külső mélyedés alját. A stabil és reprodukálható eredmények biztosítása érdekében győződjön meg arról, hogy az elektródát a lemez és a betét aljához képest 90°-os szögben stabilan tartja.
JEGYZET: Ha a minta átvitelének megakadályozása érdekében a mérések között öblítésre van szükség, desztillált víz helyett használjon sejttenyésztő médiumot. - Jegyezze fel az ellenállást.
- Határozza meg a vak ellenállást úgy, hogy egy vak lyukba/sejttenyésztési betétbe adjon médiumot vagy elektrolitoldatot (pl., a sejttenyésztő betétet sejtek és teljes sejttenyésztő közeg nélkül).
- Mérje meg az ellenállást az üres betéten, és használja ezt az értéket "nulla" vagy "háttér" ellenállási szintként. A valódi szöveti ellenállás meghatározásához vonja le az üres betéten mért ellenállást a szöveten (sejtkultúra betét sejtekkel) mért ellenállásból.
- Az ellenállás fordítottan arányos a szövet területével. Minél nagyobb a membrán, annál kisebb az ellenállás.
Egységnyi terület ellenállása (Ω × cm2) = Ellenállás (Ω) × effektív membránfelület (cm2)
MEGJEGYZÉS: Az ellenállás változhat a minta hőmérséklete, a pH és az elektróda oldatban lévő mélysége alapján.
TEER alkalmazási jegyzetek, útmutatók és egyéb források
- Using Immortalized 16HBE14o- Human Bronchial Epithelial Cell Lines to Model Respiratory Lung Diseases
- Millicell® sejtkultúra betétek és lemezek
- A TEER jobb módja
- MultiScreen® Caco-2 Assay System
Lucifer Yellow Barrier Assay Sample Protocol
Lépések
- A membrán/kút apikális és basolaterális oldaláról vegyen fel tápfolyadékot.
TIPP: Vigyázzon, hogy ne érintse meg és ne piszkálja a membránt aspirálás közben. - Mossa/öblítse le a membránt és a kutat előmelegített Hank's Balanced Salt Solution (HBSS) oldattal.
TIPP: A felmelegített HBSS a legkisebb hatással van a sejtmonolayerre; a PBS használata károsabb és a festék nagyobb százalékban történő átjutását okozza. - A HBSS-t a membrán/kút apikális és basolaterális oldaláról szívja be.
TIPP: Vigyázzon, hogy ne érintse vagy piszkálja a membránt aspirálás közben. - Adagoljon 900 µl HBSS-t a membrán basolaterális oldalára.
- Adagoljon 200 µl Lucifer sárga festéket (100 µg/mL) a membrán apikális oldalára.
TIPP: Legyen nagyon óvatos, nehogy véletlenül Lucifer sárga festéket adjon hozzá, vagy a bazolaterális rekeszbe fröccsenjen/csöpögjön. Ez megzavarja a vizsgálati eredmények pontosságát. Pipettázás közben ne bökdösse a membránt. - Tegye 37 °C-os, 5% CO2-os inkubátorba 1 órára. Növelje az inkubációs időt 2-3 órára az olyan alacsony porozitású membránok esetében, mint a 0,4 µm-es átlátszó Millicell® betétek (PCHT24H48).
TIPP: A legjobb eredmény érdekében tartsa a lemezt laposan, és ne rázza. - Azt az időt használja fel arra, hogy standardokat készítsen a vizsgálati lemezhez, amelyek azonosítják a mintaértékeket.
a. Készítsen egy 100%-os standardot [Std(100)] a következők egyesítésével:
200 µL Lucifer sárga festék (100 µg/mL) és 900 µL HBSS kombinálásával.
b. Hígítsuk fel a standardokat 1:1 arányban sorozatos hígításban.
500 µL Std(100) 500 µL HBSS-szel együtt adná a Std(50)
c. A legalacsonyabb standardnak (a 100%-os HBSS mellett) 0,39% Lucifer-sárgát kell tartalmaznia (ez kilenc standardot és egy tizedik HBSS-t jelentene
).
d. Adjunk 100 µL-t minden standardból egy fluoreszcencia spektroszkópiai lemezbe (három példányban). - Vegyük ki a lemezt az inkubátorból, és gyűjtsünk 100 µL folyadékot a membránok basolaterális oldaláról, hogy a fluoreszcencia spektroszkópiai lemezbe helyezzük.
TIPP: A legjobb eredmények érdekében ezt három példányban végezze el, hogy az eredmények technikai ismétlésként átlagolhatók legyenek. - Olvassa le a fluoreszcens spektroszkópiai lemezt egy lemezolvasón, és határozza meg a fluoreszcens abszorbanciát 485 nm gerjesztési és 535 nm emissziós hullámhosszon.
- A generált standard görbét használja a Lucifer-sárga koncentráció kiszámításához minden egyes mélyedésben. Ezek az értékek ezután felhasználhatók az egyes minták százalékos átmenési arányának meghatározásához.
RFU = relatív fluoreszcencia units, amelyet a lemezolvasó rendel hozzá.


3. ábra. Az ábrázolt membránok nagy sűrűségű (1×108) 0,4 µm pórusméretű PET 24 lyukú membránok. Ezek az eredmények a Millicell® függő sejttenyésztő betéteket (PTHT24H48) két hasonló márkájú betéttel hasonlítják össze. Az MDCK-sejteket mindhárom gyártónál párhuzamosan, azonos vetési sűrűséggel vetettük be. A három márkájú betétek nem különböznek egymástól szignifikánsan a vetést követő 7. napon, és hasonló kinetikát követnek a monoréteg kialakulásában.

4. ábra. A Lucifer-sárga permeabilitási próbák a sejtmonoréteg és a sejtek közötti szoros kötések kialakulását vizsgálják. Minden ábrázolt membrán nagy sűrűségű (1 x 108 pórusú) 0,4 µm pórusméretű PET-membrán 24 lyuk formátumban. Ezek az eredmények a Millicell® függő sejttenyésztő betétet (PTHT24H48) két másik márkájú betéttel hasonlítják össze. Ezt a vizsgálatot a 3. ábra szerinti vizsgálat 7. napján végeztük. A gátképzés akkor tekinthető sikeresnek, ha a festék kevesebb, mint 5%-ban jut át a membrán apikális oldaláról a membrán bazolaterális oldalára (az 1. ábra utolsó paneljén ábrázolt átjutás). E betétek között nem volt statisztikai különbség.

5. ábra. A TEER-értékek a kiindulási vetési sűrűségtől függnek, amely a sejtek összefolyásával korrelál a Millicell® függő sejttenyésztő betéten. A nagyobb sejtbeültetési sűrűségek gyorsabban képeznek sejtmonoréteget. A kísérlettől függően a vizsgálat fókuszától függően előnyösebb lehet a magasabb vagy alacsonyabb vetési sűrűség. A fenti példában az MDCK sejteket ugyanabból az állományból vetettük be, és a jelzett napokon mértük az ellenálló képességet. Minden mérést a Millicell® ERS 3.0 digitális voltohmméterrel végeztünk, Millicell® függő sejttenyésztő betétekkel (PTHT24H48).
Barrier Assay tippek és trükkök
- Válassza ki a sejttípusának és a vizsgálatnak leginkább megfelelő membránt (lásd az 1. táblázatot .nbsp;fent)
- Médiumot cseréljen minden második nap, hogy a sejtek elegendő tápanyaghoz jussanak, és fenntartsák a monoréteg/szoros csomópontok kialakulásához szükséges létfontosságú sejtjelzést.
- Ne hagyja a sejteket hosszabb időre az inkubátoron kívül a vizsgálatok előtt. Ez negatívan befolyásolhatja a Lucifer-sárga permeabilitási vizsgálat, valamint más hasonló vizsgálatok eredményeit.
- Győződjön meg arról, hogy a TEER-szonda elektródái teljesen a közegbe vannak merítve a legstabilabb mérési eredmények érdekében.
- A következetes és összehasonlítható leolvasások érdekében tartsa a TEER-szondát minden egyes kútban/betétben ugyanolyan mélyen.
- A stabil és reprodukálható eredmények biztosítása érdekében győződjön meg arról, hogy az elektróda 90°-os szögben helyezkedik el a lemezbetéthez képest.
- A hőmérséklet függvényében változhat az ellenállás. A TEER-mérések alacsonyabb hőmérsékleten (alacsonyabb °C) növekednek (magasabb Ωm Ω). A leolvasás előtt mindenképpen várjon, amíg a minták szobahőmérsékletre akklimatizálódnak.
- Az ellenállást befolyásolja a közeg pH-ja. Az inkubátorból azonnal kihúzott mintákban magasabb szén-dioxid-tartalom lesz jelen, ami alacsonyabb ellenállási értékekkel jár. A szén-dioxid mennyisége a szobahőmérséklethez való akklimatizálódás során kiegyenlítődik a légköri szén-dioxiddal.
- Tisztítsa a TEER elektródákat rendszeresen enzimatikus tisztítószerrel, például Tergazyme®-val, hogy eltávolítsa a sejttenyésztési közegből az elektródra rakódott fehérjéket. Ez a tisztítási eljárás megtalálható a Millicell® ERS 3.0 felhasználói kézikönyv.
- A Millicell® ERS 3.0 modell kábele érzékenyebb a rádióhullámok okozta interferenciára. Ezek mobiltelefonokból, laptopokból, számítógépekből, sugárzó berendezésekből (MRI, röntgen stb.), sőt még okosórákból is származnak. Fontolja meg a vizsgálati terület áthelyezését olyan területre, ahol a legkevesebb ilyen zavaró tényező van.
- Soha ne tegye a Millicell® ERS 3.0 voltohmmérőt vagy annak elektródaszondáját UV-fény alá. Ez károsítja az elektródaérzékelőt, és pontatlan, változó, vagy a mérés elmaradásához vezet.
- Ha a minta átvitelének megakadályozása érdekében a mérések között öblítésre van szükség, desztillált víz helyett használjon sejttenyésztő közeget.
- Vigyázzon, hogy a membránt ne érintse vagy piszkálja a szívás közben.
- A Lucifer-sárga permeabilitási vizsgálat során az előmelegített HBSS van a legkisebb hatással a sejtmonorétegre; a PBS használata károsabb, és nagyobb százalékban okoz festékátáramlást.
- Nagyon óvatosnak kell lennie, nehogy véletlenül Lucifer-sárga festéket adjon hozzá, vagy a bazolaterális rekeszbe kiömöljön/csöpögjön. Ez megzavarja a vizsgálati eredmények pontosságát. Ne piszkálja a membránt pipettázás közben.
- Mihelyt a Lucifer sárga festéket a membránhoz adta, a legjobb eredmények érdekében tartsa a lemezt laposan, és ne rázza.
- A Lucifer sárga permeabilitási vizsgálat végén a keverés után gyűjtse össze a basolaterális folyadékot (pipettázza fel és le), majd a legjobb eredmény érdekében futtassa le az átjutási eredményeket technikai háromszorosokban.
1 - 20
21 - 40
41 - 60
61 - 80
81 - 82
Az olvasás folytatásához jelentkezzen be vagy hozzon létre egy felhasználói fiókot.
Még nem rendelkezik fiókkal?