推荐产品
生物源
bovine lung
品質等級
形狀
lyophilized
包裝
pkg of 10 mg (10236624001)
pkg of 100 mg (11583794001)
pkg of 50 mg (10981532001)
製造商/商標名
Roche
技術
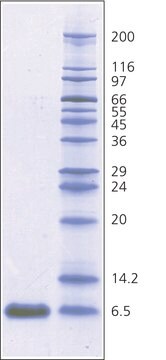
electrophoresis: suitable
tissue culture: suitable
pH值範圍
3-10
溶解度
water: soluble 10 mg/mL
吸收
0.84 at 280 nm
運輸包裝
wet ice
儲存溫度
2-8°C
一般說明
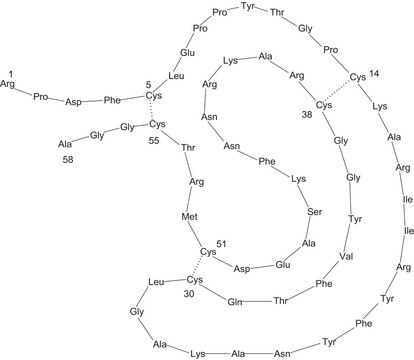
胰蛋白酶抑制剂,牛肺胰腺型。它被称为胰蛋白酶抑制剂(BPTI)。抑肽酶,也称为胰胰蛋白酶抑制剂和胰蛋白酶激肽释放酶抑制剂,被发现在肺、脾、肝和胰腺中表达。还发现它以游离形式存在于小牛血清中。
特異性
抑肽酶抑制丝氨酸蛋白酶。它抑制激肽释放酶,即释放降血压肽的蛋白酶,如激肽和缓激肽(人血浆激肽释放酶:Ki = 3 ×10-8 M,pH8.0),猪胰腺激肽释放酶:K = 1 × 10-9 M,pH8.0,胰蛋白酶(,Ki = 2.8 × 10-11 M,pH 7.8, Ki = 2.6 × 10-9 M at pH 4.0,不完全),胰蛋白酶原,胰凝乳蛋白酶(Ki = 9 × 10-9 M at pH 8.0),细菌纤维蛋白溶酶和纤溶酶(Ki= 1 nM,pH 7.3)。
组织蛋白酶G、顶体酶、人白细胞弹性蛋白酶和人尿激酶受到微弱抑制。Xa因子、凝血酶、枯草杆菌蛋白酶、木瓜蛋白酶、胃蛋白酶、血管紧张素转换酶、羧肽酶A和B、其他金属蛋白酶和硫蛋白酶不受抑制。
组织蛋白酶G、顶体酶、人白细胞弹性蛋白酶和人尿激酶受到微弱抑制。Xa因子、凝血酶、枯草杆菌蛋白酶、木瓜蛋白酶、胃蛋白酶、血管紧张素转换酶、羧肽酶A和B、其他金属蛋白酶和硫蛋白酶不受抑制。
應用
抑肽酶用于在分离/纯化过程中保护蛋白质和酶。蛋白酶活性的抑制增加了细胞和组织培养研究中细胞的寿命。
- 进一步应用:在固定化抑肽酶上纯化尿激酶、胰蛋白酶和糜蛋白酶
- 酯酶和蛋白酶混合物中激肽释放酶活性的定量
- 通过避免临床化学试验中的非特异性蛋白水解来控制底物的降解
- 抑肽酶作为蛋白质折叠研究中的模型蛋白质
- SDS-聚丙烯酰胺凝胶电泳中的分子量标记
序列
由58个氨基酸组成的单体肽,通过三个二硫键保持构象。
單位定義
One inhibitor unit (IU) is defined as the amount of aprotinin that completely inhibits 1 U trypsin in < 10 minutes at pH 6. (Trypsin activity determined at +25 °C, pH 8.0, BAEE as substrate).
一个抑制剂单位(IU)(+25℃,BAEE为底物)相当于约2.8个抑制剂单位(+25℃,色酶TRY为底物)。
一个抑制剂单位(IU)(+25℃,BAEE为底物)相当于约26个激肽释放酶抑制剂单位(KIU)(+25℃)。
一个抑制剂单位(国际单位)(+25℃,BAEE为底物)相当于约0.067个抑制剂单位(+25℃;Bz-D,L-精氨酸-4-钠为底物,胰蛋白酶在pH 7.8测定)。
一个激肽释放酶抑制剂单位= 0.17 & # 956;g结晶抑肽酶。
一个抑制剂单位(IU)(+25℃,BAEE为底物)相当于约2.8个抑制剂单位(+25℃,色酶TRY为底物)。
一个抑制剂单位(IU)(+25℃,BAEE为底物)相当于约26个激肽释放酶抑制剂单位(KIU)(+25℃)。
一个抑制剂单位(国际单位)(+25℃,BAEE为底物)相当于约0.067个抑制剂单位(+25℃;Bz-D,L-精氨酸-4-钠为底物,胰蛋白酶在pH 7.8测定)。
一个激肽释放酶抑制剂单位= 0.17 & # 956;g结晶抑肽酶。
準備報告
工作浓度:0.06至2 & # 956; g/ml(0.01-0.3 & # 956; M)
工作溶液:溶于水(10毫克/毫升)或缓冲水溶液(例如0.1 M Tris,pH 8.0)。
注:为避免抑肽酶吸附在带负电荷的固相上,例如色谱凝胶、超滤膜,氯化钠浓度应高于0.1 M,或在分离过程中使用的所有缓冲液中应加入其他合适的盐。
储存条件(工作溶液):-15至-25℃
工作溶液:溶于水(10毫克/毫升)或缓冲水溶液(例如0.1 M Tris,pH 8.0)。
注:为避免抑肽酶吸附在带负电荷的固相上,例如色谱凝胶、超滤膜,氯化钠浓度应高于0.1 M,或在分离过程中使用的所有缓冲液中应加入其他合适的盐。
储存条件(工作溶液):-15至-25℃
重構
其他說明
仅用于生命科学研究。不可用于诊断。
儲存類別代碼
11 - Combustible Solids
水污染物質分類(WGK)
WGK 1
閃點(°F)
Not applicable
閃點(°C)
Not applicable
其他客户在看
Kamlesh Shroff et al.
Langmuir : the ACS journal of surfaces and colloids, 28(3), 1858-1865 (2011-12-14)
In recent years, a variety of biomimetic constructs have emerged which mimic the bioactive sequences found in the natural extracellular matrix (ECM) proteins such as fibronectin (FN) that promote cell adhesion as well as proliferation on artificially functionalized interfaces. Much
[EXPERIMENTS ON THE ISOLATION OF THE KALLIKREIN INACTIVATOR. V. THE ISOLATION OF A KALLIKREIN INACTIVATOR FROM THE BOVINE LUNG AND ITS IDENTIFICATION WITH THE INHIBITOR FROM THE BOVINE PAROTID GLAND].
H KRAUT et al.
Hoppe-Seyler's Zeitschrift fur physiologische Chemie, 338, 231-237 (1964-01-01)
Glucose Starvation Increases V-ATPase Assembly and Activity in Mammalian Cells through AMP
Kinase and Phosphatidylinositide 3-Kinase/Akt Signaling
Kinase and Phosphatidylinositide 3-Kinase/Akt Signaling
Christina M. McGuire and Michael Forgac
The Journal of Biological Chemistry (2018)
Selecting protein N-terminal peptides by combined
fractional diagonal chromatography
fractional diagonal chromatography
An S, et al.
Nature Protocols (2011)
H Fritz et al.
Hoppe-Seyler's Zeitschrift fur physiologische Chemie, 360(3), 437-444 (1979-03-01)
Using the indirect immunofluorescence technique, the basic kallikrein-trypsin inhibitor of bovine organs, Trasylol, could be localized in tissue mast cells of bovine lung, liver, pancreas and parotid gland. Identification of cells exhibiting specific fluorescence as tissue mast cells was achieved
商品
While aprotinin and bovine pancreatic trypsin inhibitor (BPTI) are the same protein sequence, the term aprotinin is typically used when describing the protein derived from bovine lung.
我们的科学家团队拥有各种研究领域经验,包括生命科学、材料科学、化学合成、色谱、分析及许多其他领域.
联系技术服务部门