Přehled glykoproteinů s vazbou O
O-vázané glykoproteiny jsou obvykle velké proteiny s molekulovou hmotností >200 kDa. Glykosylace se obvykle vyskytuje ve shlucích s vysokou hustotou a může představovat až 50-80 % celkové hmotnosti.
Struktura
O-vázané glykany jsou nejčastěji připojeny k peptidovému řetězci prostřednictvím serinových (Ser) nebo threoninových (Thr) zbytků. Ačkoli se O-vazby vážou primárně k peptidovým zbytkům prostřednictvím hydroxylové skupiny, není vyžadována žádná konsenzuální sekvence. Místem peptidové O-vázané glykosylace může být také tyrosin (Tyr), hydroxylysin (Hydroxy-Lys) nebo hydroxyprolin (Hydroxy-Pro).
Nejběžnějšími O-vázanými glykany jsou glykany mucinového typu, které obsahují počáteční GalNAc zbytek. Existuje osm základních struktur mucinového typu (obrázek 1). I u běžných jader mucinového typu bývají O-vázané glykany velmi heterogenní a kromě několika sialylovaných jaderných struktur jsou možné i jiné struktury. O-vázané glykany jsou však běžně lineární nebo bianténní a mají relativně méně větvení než N-glykany.

Obrázek 1.Jádrové struktury O-glykanů mucinového typu.
Muciny jsou glykoproteiny, které obsahují velké množství shluků glykanů s vysokou hustotou O-vazby. Glykany mucinového typu těchto proteinů často vytvářejí ve vodných roztocích zesíťované spoje, což vede ke vzniku gelu s vysokou viskozitou (hlenu). Muciny mohou být vylučovány, ale mohou být také vázány na membránu a vytvářet oblasti s hustými glykany na povrchu buněk. Kromě glykanů mucinového typu mohou O-vázané glykany obsahovat jiné cukry než GalNAc jako výchozí cukr navázaný na serinové/treoninové zbytky. Příklady alternativních O-vázaných glykanů jsou:
- Jaderné a cytoplazmatické glykoproteiny, které obsahují GlcNAc jako počáteční cukr.
- Fibrinolytické a koagulační faktory, které obsahují fukózu jako iniciační cukr.
- Mannoproteiny typické pro kvasinky, které obsahují manózu jako iniciační cukr. O-mannosylové glykany se nacházejí také v lidském α-dystroglykanu a dalších glykoproteinech nervového systému.
- Glykosaminoglykany (GAG), které jsou součástí proteoglykanových struktur a obsahují xylosu vázanou výhradně na serinové zbytky.
- Extenzy rostlinné buněčné stěny, které obsahují jak arabinosu navázanou na hydroxyprolin, tak galaktosu navázanou na serin.
- Rostlinné arabinogalaktany, které jsou navázány na hydroxyprolin v rámci peptidové páteře prostřednictvím O-vázané galaktózy nebo glukózy.
- Galaktóza a αGlc(1→2)Gal zbytky, které jsou vázány na hydroxylysin v rámci trojitých šroubovicových struktur kolagenu. Komplementový faktor C1q také obsahuje αGlc(1→2)Gal-hydroxyprolinové sekvence.
- Glykogenin, proteinový prekurzor potřebný pro syntézu glykogenu, obsahuje glukózu vázanou O-vazbou na tyrosin; počáteční glukóza je následně prodloužena glykogen syntázou za vzniku glykogenu.
Biosyntéza a degradace
O-vázaná glykosylace je skutečnou posttranslační událostí, která probíhá v Golgiho chromozomu, a k přenosu bílkovin není zapotřebí žádný oligosacharidový prekurzor. Serinové/treoninové zbytky jsou modifikovány přímo kovalentním přidáním N-acetylgalaktosaminových zbytků. Iniciace O-glykosylace mucinového typu je závislá na polypeptidové N-acetylgalaktosyltransferáze (ppGalNAcT); bylo identifikováno nejméně dvanáct savčích ppGalNAcT isozymů. První krok syntézy glykanů mucinového typu vyžaduje katalýzu ppGalNAcT v přítomnosti UDP-GalNAc jako donoru sacharidů. Následnou elongaci a terminaci O-vázaných glykanů provádí několik glykosyltransferáz. Relativní exprese a subcelulární distribuce různých glykosyltransferáz určuje výsledek biosyntézy O-glykanů. Terminace O-vázaných glykanů obvykle zahrnuje Gal, GlcNAc, GalNAc, Fuc nebo kyselinu sialovou. Zdaleka nejčastější modifikací jádra Gal-β(1→3)-GalNAc je mono-, di- nebo trisialylace (jádro 1 a 2) (obrázek 2). Méně častá, ale široce rozšířená O-vázaná hexasacharidová struktura obsahuje β(1→4)-vázaný Gal a β(1→6)-vázaný GlcNAc a také kyselinu sialovou.

Obrázek 2.Disialylované (nahoře) a trisialylované (dole) O-vázané glykany jádra 1.
O-glykanová degradace vyžaduje kromě exoglykosidáz potřebných pro degradaci N-glykanu také α-N-acetylgalaktosaminidázu.
Funkce
Sekreční muciny na apikální membráně epiteliálních buněk se mohou spojovat disulfidovými vazbami a zachycovat molekuly vody, čímž vytvářejí hlenovou membránu. Membrána fyzicky chrání buňku před nepřátelskými faktory prostředí, jako jsou žaludeční kyseliny a cirkulující proteázy. Sekrece mucinů slinnými žlázami zajišťuje lubrikaci při polykání. Muciny také blokují infekci patogenů tím, že představují stěnu z O-vázaných glykanů, která přitahuje a váže receptory vázající sacharidy bakterií. Mnoho bakteriálních patogenů exprimuje adheziny, proteiny rozpoznávající sacharidy specifické pro O-glykanové struktury na povrchu buněk, které fungují jako receptory pro vazbu a infikování hostitelských buněk. Adheziny se vážou na povrchové mucinové glykany a brání dalšímu postupu patogenu; navázaný patogen pak může být eliminován.
Glykosylace jedinou GlcNAc částí je jedinečnou formou O-glykosylace, neboť se ukázalo, že je dynamická, nikoli statická jako jiné typy O-vázané glykosylace. Tato modifikace je reverzibilní a katalyzují ji enzymy uridin difosfo-N-acetylglukosmin: polypeptidová β-N-acetylglukosaminltransferáza (O-GlcNAc transferáza) a neutrální β-N-acetylglukosaminidáza (O-GlcNAcase). Proteiny, které jsou vázány O-glykanem, mohou být alternativně fosforylovány na stejném peptidovém místě a podobně jako fosforylace je zpracování O-GlcNAc spojeno s buněčnými signálními ději, včetně inzulinové signalizace a regulace transkripce RNA.1,2
Složitější O-glykany plní další funkce. Glykoproteiny ZP jsou O-vázané glykany přítomné ve vysokých koncentracích v zona pellucida obklopující savčí vajíčka. Lidská ZP matrix obsahuje čtyři ZP glykoproteiny, zatímco myší ZP matrix má pouze tři.3 Role ZP glykoproteinů nebyla zcela určena, ale předpokládá se, že souvisí s příjmem spermií.
O-vázané glykany jsou také zapojeny do mechanismů krvetvorby a reakce na zánět. P-selektinový glykoproteinový ligand 1 (PSGL-1) obsahuje kromě jiných glykanů O-glykan Core 2 zakončený sialylem Lewis X (C2-O-sLeX, obrázek 3). PSGL-1 je primárním adhezním cílem pro P-selektin a cílem pro E-selektin, které se podílejí na rolování leukocytů a jejich náboru do míst zánětu.4

Obrázek 3.Struktura O-vázaného glykanu Core 2 s připojeným sialylem Lewis X (sLex).
Lidské krevní antigeny ABO jsou malé O-vázané glykany, které mohou být navázány na membránové glykoproteiny nebo na glykolipidy na povrchu buněk. Antigeny mohou být také vylučovány tkáněmi jako volné oligosacharidy nebo jako součásti rozpustných glykoproteinů a glykosfingolipidů. Determinant krevní skupiny O(H) nevyvolává imunitní odpověď, ale po modifikaci přidáním α(1→3)GalNAc (antigen krevní skupiny A) nebo α(1→3)Gal (antigen krevní skupiny B) výsledný trisacharid vyvolává imunitní odpověď (obrázek 4).
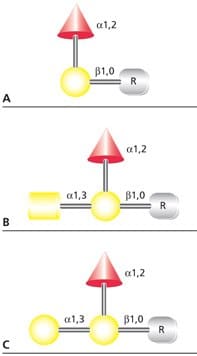
Obrázek 4.Struktura antigenů (A) krevní skupiny H(O), (B) krevní skupiny A a (C) krevní skupiny B. R představuje aminokyselinu obsahující hydroxyl nebo vazebné místo pro lipidový antigen.
T antigen a Tn antigen jsou O-glykany s neúplnou glykosylací. T antigen (tumor-associated nebo TF (Thomsen-Fridenreich) antigen) je disacharid jádra 1 (Gal-β(1→3)GalNAc), který vzniká po desialylaci virovou nebo bakteriální neuraminidázou. T antigen může vzniknout také v důsledku změn dostupných glykosyltransferáz. Tn antigen je O-vázaný GalNAc, který není glykosyltransferázou prodloužen do úplné struktury jádra. Tyto antigeny nejsou exprimovány na povrchu normálních buněk, ale jsou běžně přítomny v nádorových buňkách a mohou sloužit jako nádorové markery.
Schindlerova choroba byla identifikována jako vrozená porucha glykosylace, která postihuje O-vázané glykany a je způsobena nedostatkem α-Nacetylgalaktosaminidázy.
Network error: Failed to fetch
Odkazy
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?Toto je strojově přeložená stránka.