Odstranění značky GST enzymatickým štěpením
Odstranění značky GST je často nezbytné pro provedení funkčních nebo strukturních studií cílového proteinu. Značené proteiny obsahující rozpoznávací místo pro preScission proteázu, trombin nebo faktor Xa mohou být štěpeny buď při vazbě na glutathionovou sefarosu®, nebo v roztoku po eluci. Štěpení uvolní cílový protein z kolony a umožní eluci pomocí vazebného pufru. Část GST zůstává navázána na médium.
PreScission Protease sama o sobě má značku GST, a proto se váže na glutathion sefarosu; nedojde tedy ke koelutaci a kontaminaci štěpeného cílového proteinu. Štěpení pomocí proteázy PreScission Protease je velmi specifické a maximálního štěpení je dosaženo v chladu (protein je nejaktivnější při 4 °C), čímž se zvyšuje stabilita cílového proteinu.
Pokud se ke štěpení značky používá trombin nebo faktor Xa, vhodným způsobem odstranění těchto enzymů je sériové zapojení jedné kolony GSTrap™ FF a jedné kolony HiTrap™ Benzamidine FF (high sub). Během eluce přechází odštěpený produkt přímo z kolony GSTrap™ do kolony HiTrap™ Benzamidine FF (high sub). Štěpený cílový protein prochází kolonou HiTrap™ Benzamidine FF (high sub), ale proteázy se vážou. V jediném kroku se tak odstraní enzymy a získá se čistý rozštěpený cílový protein (obrázek 5.17). Všimněte si však, že trombin a faktor Xa mohou způsobit méně specifické štěpení než proteáza PreScission a že někdy může dojít k fragmentaci samotného cílového proteinu.
1 PreScission Protease je značený protein glutathion S-transferázy a proteázy 3C lidského rhinoviru typu 14.
Množství enzymu, teplota a délka inkubace potřebná k úplnému rozkladu se liší podle vyráběného proteinu značeného GST specific. Optimální podmínky by měly být vždy stanoveny v pilotních experimentech.
Pokud byly v lyzačním roztoku použity inhibitory proteáz (Tabulka 5.6), musí být před štěpením pomocí proteázy PreScission, trombinu nebo faktoru Xa odstraněny. (Inhibitory se obvykle eluují ve flowthrough, když je vzorek vložen na kolonu GSTrap™)
.Kleavace značených proteinů se nejčastěji provádí u miligramových množství značených proteinů vhodných pro purifikaci na kolonách GSTrap™. Následující protokoly popisují manuální štěpení a purifikaci pomocí stříkačky a 1 ml nebo 5 ml kolony GSTrap™. Protokoly lze upravit pro použití s kolonami GST MultiTrap™ nebo GST SpinTrap™ pro práci v menším měřítku.
Pro rychlé zvětšení rozsahu purifikací lze zapojit dvě nebo tři kolony GSTrap™ do série (protitlak bude vyšší). Další škálování je možné pomocí kolon GSTPrep™ FF 16/10 nebo kolon balených uživatelem. Níže jsou uvedeny protokoly pro kolonu nebo dávkový formát s použitím glutathionové sepharosy® 4 Fast Flow, ale toto médium lze snadno nahradit glutathionovou sepharosou 4 Fast Flow.sup>® High Performance nebo Glutathion Sepharose® 4B podle toho, jaké chromatografické médium je v laboratoři preferováno.

Obrázek 5.17Štěpení značky GST pomocí trombinu nebo faktoru Xa.
Štěpení a purifikace proteinu značeného GST navázaného na GSTrap™ FF |
|---|
Purifikace a štěpení
Níže uvedený protokol je příkladem optimalizovaným pro 8 mg cílového proteinu. Vyplatí se odhadnout, kolik cílového proteinu se aplikuje na kolonu, protože to umožňuje minimalizovat množství přidané proteázy.
- Naplňte stříkačku nebo hadičku pumpy destilovanou vodou. Odstraňte zátku a připojte kolonu ke stříkačce (použijte dodaný konektor), laboratorní pumpě nebo chromatografickému systému "po kapkách", aby se do systému nedostal vzduch.
- Odstraňte zacvakávací koncovku na výstupu kolony.
- Vymyjte ethanol 3 až 5 objemy destilované vody z kolony.
- Ekvilibrace kolony nejméně 5 objemy vazebného pufru. Doporučené rychlosti průtoku jsou 1 ml/min (kolona o objemu 1 ml) a 5 ml/min (kolona o objemu 5 ml).
- Předem upravený vzorek aplikujte pomocí stříkačky připojené k Luerovu konektoru nebo napumpováním na kolonu. Pro dosažení nejlepších výsledků použijte při nanášení vzorku rychlost fluování 0,2 až 1 ml/min (1 ml kolona) a 0,5 až 5 ml/min (5 ml kolona).
- Proplachujte vazebným pufrem (obvykle alespoň 5 až 10 objemů kolony), dokud absorbance nedosáhne ustálené základní hodnoty nebo dokud v effluentu nezůstane žádný materiál. Udržujte rychlost flow 1 až 2 ml/min (kolona o objemu 1 ml) a 5 až 10 ml/min (kolona o objemu 5 ml) pro promývání.
- Pro PreScission Protease a Factor Xa, promyjte kolonu 10 objemy štěpného pufru.
Pro trombin, přejděte ke kroku 8b.
Pro faktor Xa, přejděte ke kroku 8c. - a) Připravte směs PreScission Protease:
Pro kolonky GSTrap™ FF 1 mL smíchejte 80 µl (160 jednotek) PreScission Protease s 920 µl štěpicího pufru PreScission při 5 °C.
Pro kolonky GSTrap™ FF 5 ml smíchejte 400 µl (800 jednotek) proteázy PreScission s 4,6 ml štěpicího pufru PreScission při 5 °C.
b) Připravte směs trombinu:
Pro kolonky GSTrap™ FF 1 mL smíchejte 80 µl (80 jednotek) roztoku trombinu s 920 µl PBS.
Pro kolonky GSTrap™ FF 5 ml smíchejte 400 µl (400 jednotek) roztoku trombinu s 4,6 ml PBS.
c) Příprava směsi faktoru Xa:
Pro kolonky GSTrap™ FF 1 ml, smíchejte 80 µl (80 jednotek) roztoku faktoru Xa s 920 µl štěpného pufru faktoru Xa.
Pro kolonky GSTrap™ FF 5 ml, smíchejte 400 µl (400 jednotek) roztoku faktoru Xa s 4,6 ml štěpícího pufru faktoru Xa. - Naložíte směs proteáz na kolonku pomocí stříkačky a dodaného konektoru. Kolonu uzavřete horním uzávěrem a dodanou zátkou.
- Pro proteázu PreScission, inkubujte kolonu při 5 °C po dobu 4 h.
Pro trombin a faktor Xa, inkubujte kolonu při pokojové teplotě (22 °C až 25 °C) po dobu 2 až 16 h.
Doby inkubace jsou výchozími hodnotami a může být nutné je změnit pro optimální výtěžek štěpeného cílového proteinu.
- Naplňte stříkačku 3 ml (1 ml kolony) nebo 15 ml (5 ml kolony) štěpného pufru. Odstraňte horní uzávěr a zátku z kolony a připojte stříkačku. Zabraňte vniknutí vzduchu do kolony.
- Začněte eluovat štěpený cílový protein. Udržujte rychlost fluace 1 až 2 ml/min (kolona o objemu 1 ml) nebo (kolona o objemu 5 ml) a sbírejte eluát (0,5 až 1 ml/zkumavku pro kolonu o objemu 1 ml, 1 až 2 ml/zkumavku pro kolonu o objemu 5 ml).
Pro PreScission Protease: Eluát bude obsahovat protein, který vás zajímá, zatímco část GST značeného proteinu a PreScission Protease (rovněž značená GST) zůstanou vázány na koloně GSTrap™. To znamená, že zájmový protein nebude kontaminován proteázou, a proto nebude k přečištění cílového proteinu od proteázy nutná žádná další purifikace.
Pro trombin a faktor Xa: Eluát bude obsahovat zájmový protein a trombin, respektive faktor Xa, zatímco část GST značeného proteinu zůstane navázána na koloně GSTrap™. Trombin nebo faktor Xa lze ze zájmového proteinu odstranit v jednom kroku pomocí kolony HiTrap™ Benzamidine FF (high sub) v sérii za kolonou GSTrap™. Při tomto postupu se odštěpený, označený protein a trombin nebo faktor Xa promyjí z kolony GSTrap™ na kolonu HiTrap™ Benzamidine FF (high sub). Tato druhá kolona zachytí trombin nebo faktor Xa, a umožní tak shromáždit volný protein v eluentu. Na obrázku 5.20 je uveden příklad purifikace a štěpení na koloně domény SH2 značené GST pomocí trombinu a GSTrap™ FF, přičemž čištění vzorku se provádí pomocí HiTrap™ Benzamidine FF (high sub) kolony v sérii s GSTrap™ FF. Odstranění trombinu a faktoru Xa pomocí HiTrap™ Benzamidine FF (high sub) dále v této kapitole pro postup.
Příloha 2 (Characteristics of Glutathione Sepharose® products), kde najdete podrobnosti o regeneraci kolony GSTrap™ pro následné purifikace.
Příklady použití
1. Purifikace lidského hippokalcinu pomocí kolon GSTrap™ FF v sérii se štěpením na koloně proteázou PreScission
Gen pro lidský hippokalcin, člen rodiny neuron-specifických proteinů vázajících vápník, byl klonován do vektoru pGEX obsahujícího místo pro PreScission Protease sousedící s GST značkou. Expresní značený protein byl zachycen na koloně GSTrap™ FF o objemu 1 ml. Kolona byla poté inkubována přes noc při 4 °C a další 2 hodiny při pokojové teplotě s PreScission Protease (která je sama značená GST). Po štěpení na koloně byla druhá kolona GSTrap™ FF 1 ml umístěna v řadě za filmovou kolonou, aby se odstranila veškerá PreScission Protease, nečištěný protein značený GST nebo volná značka GST, která by se mohla spolu se vzorkem vyloučit během dalšího promývání vazebným pufrem (obrázek 5.18). Na každý gram vlhkých E. coli buněk bylo získáno 10 mg čistého, neznačeného hippokalcinu.


Obrázek 5.18.Purifikace lidského hippokalcinem-GST značeného proteinu se štěpením na koloně a odstraněním proteázy PreScission po štěpení pomocí kolon GSTrap™ FF. (A) Chromatogram ukazující purifikaci hippokalcinu. (B) Analýza SDS-PAGE různých kroků zpracování vzorku. ExcelGel SDS Gradient, 8-18, barvení Coomassieho modří.
2. Automatické odstranění značky GST pomocí proteázy PreScission
Tento příklad automatického odstranění značky používá ÄKTAxpress. Všechny vícekrokové purifikační protokoly v aplikaci ÄKTAxpress lze kombinovat s automatickým štěpením značky na koloně. Štěpení značek se vždy provádí na afunkční koloně před dalšími purifikačními kroky. Po eluci štěpeného proteinu se affinitní kolona regeneruje a affinitní značka, značená proteáza a zbývající neštěpený protein se shromáždí v odděleném výstupu. Postup zahrnuje navázání značeného proteinu, vstříknutí proteázy, inkubaci, eluci štěpeného proteinu a sběr do kapilární smyčky (smyček), po kterém následují další purifikační kroky.
Příklad na obrázku 5.19 ukazuje výsledky purifikace pro protein značený GST, GST-purα (Mr 61 600), exprimovaný v E. coli. Mr štěpeného produktu je 35 200. Po sklizni byla provedena lýza buněk sonikací. Vzorky byly před načtením vzorku vyčištěny odstředěním.
AC a SEC byly provedeny na ÄKTAxpress s použitím kolonek podle figurky. Čistota každého vzorku byla analyzována pomocí SDS-PAGE (barvení Coomassie). Redukované vzorky byly naneseny na SDS-polyakrylamidový gel ExcelGel.

Obrázek 5.19.(A) Dvoufázový protokol pro automatické štěpení GST-značených proteinů pomocí proteázy PreScission a purifikaci. (B) Analýza pomocí SDS-polyakrylamidového gelu (barvení Coomassie) neznačeného cílového proteinu po purifikaci a štěpení.
3. Purifikace a štěpení domény SH2 značené GST na koloně pomocí trombinu a GSTrap™ FF. Přímé odstranění trombinu pomocí HiTrap™ Benzamidine FF (high sub) kolony v sérii s GSTrap™ FF
Následující aplikace popisuje purifikaci trombinu pomocí HiTrap™ Benzamidine FF.cování GST-SH2 (Mr 37 000) na koloně GSTrap™ FF o objemu 1 ml, po kterém následuje štěpení trombinem na koloně (obrázek 5.20). Po kroku inkubace s trombinem byla za kolonu GSTrap™ FF v sérii umístěna kolona HiTrap™ Benzamidine FF (high sub) 1 ml. Když byly kolony promyty vazebným pufrem a později pufrem s vysokým obsahem soli, došlo k promytí štěpeného proteinu značeného SH2 a trombinu z kolony GSTrap™ FF na kolonu HiTrap™ Benzamidine FF (high sub). Trombin byl zachycen touto druhou kolonou, což umožnilo shromáždit v eluentu čistý cílový protein bez trombinu (obrázek 5.20A). Úplné odstranění trombinu bylo ověřeno pomocí chromogenního substrátu S-2238 (Chromogenix, Haemochrom Diagnostica AB; dodavatelem v USA je DiaPharma) pro detekci aktivity trombinu (obr. 5.20B). Celý tento postup bylo možné dokončit za méně než jeden den.


Obrázek 5.20.Purifikace proteinu značeného GST-SH2 GST se štěpením na koloně a odstraněním trombinu po štěpení pomocí kolon GSTrap™ FF a HiTrap™ Benzamidine FF (high sub). (A) SDS-PAGE analýza různých kroků zpracování vzorku. ExcelGel SDS Gradient 8-18, barvení Coomassieho modří. (B) Chromatogram (modře: absorbance při 280 nm) a křivka aktivity trombinu (červeně) demonstrující všechny kroky purifikace domény SH2.
4. Štěpení proteinu značeného GST na koloně GSTrap™ FF pomocí trombinu
Pro demonstraci účinnosti štěpení na koloně ve spojení s purifikací byl protein značený GST, který obsahoval rozpoznávací sekvenci pro trombin, použit na koloně GSTrap™ FF 1 ml. Po promytí byla kolona stříkačkou filtrována 1 ml roztoku trombinu (20 U/ml v PBS, pH 7,3) a uzavřena pomocí dodaných konektorů. Po 16hodinové inkubaci při pokojové teplotě byl cílový protein bez části GST eluován pomocí PBS, pH 7,3, a navázaný GST byl následně eluován pomocí elučního pufru (obrázek 5.21). Výtěžnost štěpné reakce byla 100 %. Intaktní protein značený GST nebyl v eluátu pomocí SDS-PAGE a barvení stříbrem detekován (obrázek 5.21C, pruh 5).
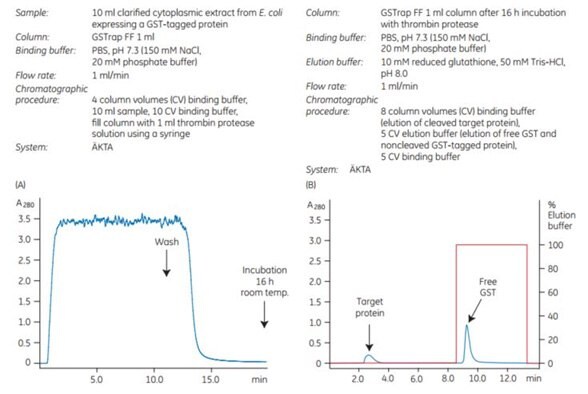

Obrázek 5.21.Štěpení proteinu značeného GST trombinem na koloně. (A) Vyrovnání, nanesení vzorku a promytí proteinu značeného GST na GSTrap™ FF 1 ml bylo provedeno pomocí chromatografického systému ÄKTA. Po promytí byla kolona stříkačkou filtrována 1 ml trombinu (20 U/ml) a inkubována 16 h při pokojové teplotě. (B) Cílový protein bez GST byl eluován pomocí PBS o pH 7,3. GST byl eluován pomocí 10 mM redukovaného glutathionu. (C) SDS-PAGE a následné barvení stříbrem. Frakce cílového proteinu bez GST obsahovala také malé množství trombinu, které nebylo detekovatelné pomocí SDS-PAGE (pruh 6). Trombin lze odstranit pomocí kolony HiTrap™ Benzamidine FF (high sub).
Purifikace a štěpení
Níže uvedený protokol je příkladem optimalizovaným pro 8 mg cílového proteinu. Vyplatí se odhadnout, kolik cílového proteinu se aplikuje na kolonu, protože to umožňuje minimalizovat množství přidané proteázy.
- Naplňte stříkačku nebo hadičku pumpy destilovanou vodou. Odstraňte zátku a připojte kolonu ke stříkačce (použijte dodaný konektor), laboratorní pumpě nebo chromatografickému systému "po kapkách", aby se do systému nedostal vzduch.
- Odstraňte zacvakávací koncovku na výstupu kolony.
- Vymyjte etanol 3 až 5 objemy destilované vody z kolony.
- Ekvilibrace kolony nejméně 5 objemy vazebného pufru. Doporučené rychlosti průtoku jsou 1 ml/min (kolona o objemu 1 ml) a 5 ml/min (kolona o objemu 5 ml).
- Předem upravený vzorek aplikujte pomocí stříkačky připojené k Luerovu konektoru nebo pumpováním na kolonu. Pro dosažení nejlepších výsledků použijte při nanášení vzorku rychlost fluování 0,2 až 1 ml/min (1 ml kolona) a 0,5 až 5 ml/min (5 ml kolona).
- Proplachujte vazebným pufrem (obvykle alespoň 5 až 10 objemů kolony), dokud absorbance nedosáhne ustálené základní hodnoty nebo dokud v effluentu nezůstane žádný materiál. Udržujte rychlost průtoku 1 až 2 ml/min (kolona o objemu 1 ml) a 5 až 10 ml/min (kolona o objemu 5 ml) pro promývání.
- Eluujte protein značený GST pomocí 5 až 10 objemů elučního pufru na koloně. Udržujte rychlost flow 1 až 2 ml/min (1 ml kolona) nebo 1 až 5 ml/min (5 ml kolona). Sbírejte eluát (0,5 až 1 ml/zkumavku pro 1 ml kolonu, 1 až 2 ml/zkumavku pro 5 ml kolonu). Shromážděte frakce obsahující protein značený GST (sledovaný UV absorpcí při A280).
- Odstraňte volný redukovaný glutathion z eluátu pomocí rychlé výměny pufru na odsolovací koloně (kapitola 11), v závislosti na objemu vzorku.
- a) Pro proteázu PreScission přidejte 1 µl (2 jednotky) proteázy PreScission na každých 100 µg značeného proteinu v eluátu vyměněného pufru.
b) Pro trombin a faktor Xa přidejte 10 µl (10 jednotek) roztoku trombinu nebo faktoru Xa na každý mg značeného proteinu v eluátu vyměněném v pufru. - a) Pro proteázu PreScission inkubujte při 5 °C po dobu 4 hodin.
b) Pro trombin a faktor Xa inkubujte
Uvedené inkubační doby jsou výchozí a může být nutné je změnit pro optimální výtěžek štěpeného cílového proteinu.
- Po dokončení štěpení naneste vzorek na ekvilibrovanou kolonu GSTrap FF, jak je popsáno výše (kroky 1 až 6), aby se odstranila část GST značeného proteinu.
Pro PreScission Protease: Průnik bude obsahovat protein, který vás zajímá, zatímco GST část značeného proteinu a PreScission Protease zůstanou vázány na koloně GSTrap. To znamená, že zájmový protein nebude kontaminován proteázou, a proto nebude k přečištění cílového proteinu od proteázy nutná žádná další purifikace.
Pro trombin a faktor Xa: floučka bude obsahovat zájmový protein a trombin, respektive faktor Xa, zatímco část GST značeného proteinu zůstane navázána na kolonku GSTrap. Trombin nebo faktor Xa lze ze zájmového proteinu odstranit v jednom kroku pomocí kolony HiTrap Benzamidine FF (high sub) v sérii za kolonou GSTrap. Při tomto postupu se odštěpený, označený protein a trombin nebo faktor Xa promyjí z kolony GSTrap na kolonu HiTrap Benzamidine FF (high sub). Tato druhá kolona zachytí trombin nebo faktor Xa, čímž umožní získat v eluentu čistý protein bez proteáz. Odstranění trombinu a faktoru Xa pomocí HiTrap Benzamidine FF (high sub) pro postup.
Příloha 2 (Characteristics of Glutathione Sepharose products), kde naleznete podrobnosti o regeneraci kolony GSTrap pro následné purifikace.
Cleavage a purifikace proteinu značeného GST navázaného na glutathion sefarose v dávkovém režimu
Glutathion Sepharose High Performance, Glutathione Sepharose 4 Fast Flow a Glutathione Sepharose 4B lze použít pro štěpení a purifikaci proteinů značených GST v dávkovém režimu.
Doporučené nárazníky |
|---|
Příprava glutathion sefarosového chromatografického média a vazba proteinu
Glutathion sefarosové médium se dodává v 20% ethanolu. Média se používají při koncentraci finální suspenze 50 %.
- Určete objem lože glutathionové sepharosy potřebný pro vaši purifikaci.
- Jemně protřepejte lahvičku, aby se suspenze resuspendovala.
- Pipetou nebo odměrným válcem odeberte dostatečné množství suspenze pro použití a přeneste ji do vhodné nádoby/zkumavky.
- Chromatografické médium odstřeďte centrifugací při 500 × g po dobu 5 min. Supernatant opatrně dekantujte.
- Propláchněte glutathionovou separaci přidáním 5 ml PBS na 1 ml 50% suspenze.
Glutathion sepharose musí být důkladně promyta PBS, aby se odstranil skladovací roztok ethanolu, protože zbytkový ethanol může interferovat s následnými postupy.
- Chromatografické médium se odstředí při 500 × g po dobu 5 min. Supernatant opatrně dekantujte.
- Kroky 5 a 6 opakujte jednou, celkem dvakrát.
- Buněčný lyzát přidejte k připravené glutathionové sefarose a inkubujte nejméně 30 min při pokojové teplotě za použití jemného míchání, např. otáčením na druhou stranu.
Purifikace a štěpení
Předpokládejte 8 mg proteinu značeného GST navázaného na 1 ml chromatografického média.
- Propláchněte glutathionovou sepharozu s navázaným značeným proteinem 10 lůžkovými objemy štěpicího pufru. Objem lože se rovná 0,5× objemu použité 50% suspenze glutathion sefarosy.
- a) Příprava směsi PreScission Protease:
Na každý ml objemu lože glutathionové sepharosy připravte směs 80 µl (160 jednotek) PreScission Protease a 920 µl štěpícího pufru při 5 °C.
b) Připravte směs trombinu:
Pro každý ml objemu lože glutathionové sefarosy připravte směs 80 µl (80 jednotek) trombinu a 920 µl štěpného pufru.
c) Připravte směs faktoru Xa:
Na každý ml objemu lože glutathionové sepharosy připravte směs 80 µl (80 jednotek) faktoru Xa a 920 µl štěpného pufru. - Přidejte směs ke glutathionové sepharose. Suspenzi jemně protřepejte nebo otáčejte koncem nahoru.
- a) Pro proteázu PreScission inkubujte 4 h při 5 °C.
b) Pro trombin nebo faktor Xa inkubujte 2 až 16 h při pokojové teplotě (22 °C až 25 °C).
Doby inkubace v krocích 4a a 4b jsou výchozími hodnotami a může být nutné je změnit pro optimální výtěžek štěpeného cílového proteinu.
- Po inkubaci vymyjte neznačený protein přibližně třemi lůžkovými objemy štěpného pufru. Suspenzi odstřeďujte při 500 × g po dobu 5 minut, abyste peletovali glutathionovou separaci. Opatrně přeneste eluát do zkumavky.
Pro PreScission Protease: Eluát bude obsahovat protein, který vás zajímá, zatímco část GST značeného proteinu a PreScission Protease zůstanou navázány na glutathion sefarose. To znamená, že zájmový protein nebude kontaminován proteázou, a proto nebude k purifikaci cílového proteinu od proteázy nutná žádná další purifikace.
Pro trombin a faktor Xa: Eluát bude obsahovat zájmový protein a trombin, respektive faktor Xa, zatímco část GST značeného proteinu zůstane vázána na glutathion sefarose. Trombin nebo faktor Xa lze ze zájmového proteinu odstranit pomocí HiTrap Benzamidine FF (high sub). Tato kolona zachytí trombin nebo faktor Xa, a umožní tak získat v eluentu čistý protein bez proteáz. postup níže.
Odstranění trombinu a faktoru Xa pomocí HiTrap Benzamidine FF (high sub)
Potřebná činidla
Vazný pufr:
0.05 M Tris-HCl, 0,5 M NaCl, pH 7,4
Alternativy elučního pufru pro eluci proteázy:
0.05 M glycin-HCl, pH 3,0
10 mM HCl, 0,5 M NaCl, pH 2.0
20 mM p-aminobenzamidin ve vazebném pufru (kompetitivní eluce) 8 M močovina nebo 6 M Gua-HCl (denaturační roztoky)
Doporučené rychlosti flow jsou 1 ml/min (1 ml kolona) nebo 5 ml/min (5 ml kolona).
- Naplňte stříkačku nebo hadičku pumpy destilovanou vodou. Odstraňte zátku a připojte kolonu ke stříkačce (použijte dodaný konektor), laboratorní pumpě nebo chromatografickému systému "po kapkách", abyste zabránili vniknutí vzduchu do kolony.
- Odstraňte zacvakávací koncovku.
- Propláchněte kolonu 5 objemy destilované vody, abyste odstranili zásobní pufr (0.05 M acetátový pufr, pH 4, obsahující 20 % ethanolu).
- Ekvilibrace kolony 5 objemy kolonového vazebného pufru.
- Podání vzorku pomocí stříkačky fitrované na Luerův konektor nebo napumpováním na kolonu. Doporučené rychlosti flučení pro aplikaci vzorku jsou 1 ml/min pro 1 ml kolony a 5 ml/min pro 5 ml kolony. Sbírejte průtok a rezervujte. Obsahuje materiál zbavený proteáz, který je třeba uložit. Aplikujte malý objem dalšího vazebného pufru, abyste z kolony zachytili veškerý požadovaný materiál.
- Promyjte kolonu 5 až 10 objemy vazebného pufru a sbírejte frakce (0,5 až 1 ml frakce pro 1 ml kolonu a 1 až 3 ml frakce pro 5 ml kolonu), dokud se v effluentu neobjeví žádný materiál (sledováno UV absorpcí při 280 nm).
- Zachyťte frakce z flokulí a/nebo promývání, které obsahují materiál bez trombinu nebo faktoru Xa (sledováno UV absorpcí při 280 nm).
- Pro opětovné použití kolony eluujte navázanou proteázu 5 až 10 objemy zvoleného elučního pufru. Pokud má být eluovaný trombin nebo faktor Xa zachován pro opětovné použití, vyměňte frakce obsahující proteázu za pufr pomocí odsolovací kolony (kapitola 11, Desalting/buffer exchange and concentration).
- Pokud byl použit eluční pufr s nízkým pH, shromážděte frakce v neutralizačním pufru.
- Po eluci všech proteáz promyjte kolonu vazebným pufrem, aby byla připravena k opětovnému použití.
Aktivitu trombinu lze sledovat odebráním alikvotů frakcí a měřením při 405 nm s použitím S-2238 (Chromogenix, Haemochrom Diagnostica AB; dodavatelem v USA je DiaPharma) jako substrátu.
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?