Avaliação dos filtros de seringa Millex® para testes de impurezas de nitrosamina em produtos farmacêuticos
Teste de impurezas de nitrosamina
Detectar e quantificar nitrosaminas em medicamentos é essencial para garantir a segurança e a qualidade dos produtos farmacêuticos. As impurezas químicas da nitrosamina são introduzidas em processos sintéticos por meio de vias múltiplas e difíceis de prever e são suspeitas de terem propriedades carcinogênicas e genotóxicas, o que representa um risco para a saúde do paciente.1-4 Elas foram detectadas em princípios ativos e excipientes, levando a muitos recalls desde 2018, inclusive da valsartana.5,6
Requisitos regulatórios para análise de nitrosaminas
Agências e organizações regulatórias farmacêuticas, como a Food and Drug Administration (FDA) dos EUA, a European Medicines Agency (EMA) e o International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH), fornecem diretrizes e requisitos relativos às nitrosaminas em produtos farmacêuticos. Um resumo dos pontos principais está listado na Tabela 1.
Essas autoridades regulatórias estão monitorando e atualizando ativamente suas diretrizes sobre impurezas de nitrosamina para garantir saúde e a segurança pública. É importante que os fabricantes de produtos farmacêuticos sigam essas diretrizes e requisitos enquanto avaliam e mitigam o risco de contaminação por nitrosamina em medicamentos.
Métodos analíticos para análise de nitrosaminas
Agências regulatórias globais, como EMA, FDA dos EUA e outras, enfatizaram a importância de métodos analíticos robustos para análise de nitrosamina em produtos farmacêuticos. LC-MS/MS é um método analítico comumente recomendado para análise de nitrosamina pelas agências regulatórias. A combinação da separação por cromatografia líquida de alto desempenho (HPLC) com a detecção por espectrometria de massa em tandem (MS/MS) permite alta sensibilidade, seletividade e precisão. O LC-MS/MS é capaz de detectar e quantificar níveis de traços das várias nitrosaminas em matrizes de amostras complexas, tornando-o adequado para análise de rotina e adesão aos limites regulatórios. USP <1469> procedimento 3 usa LC-MS/MS para a quantificação de nitrosaminas.13 FDA dos EUA, European Pharmacopeia,14 Health Sciences Agency (HSA) de Singapura,15 e Taiwan Food and Drug Administration16 também publicaram métodos LC-MS/MS para a determinação de nitrosaminas na ranitidina e outros medicamentos.
A HPLC associada à espectrometria de massa de alta resolução (HPLC-HRMS ou LC-HRMS) é outra técnica fundamental para a análise de nitrosamina. A seletividade deste método permitiu a diferenciação de impurezas semelhantes à nitrosamina das nitrosaminas reais, garantindo a confiabilidade dos resultados do teste. A FDA desenvolveu e validou os métodos LC-HRMS,17 e USP <1469> Procedimento 1 também descreve esse método.7
A HPLC com detecção UV/Vis também é usada para análise de nitrosamina. Embora possa ter sensibilidade mais baixa em comparação com LC-MS/MS, ela pode ser usada como um método rápido para a análise de matérias-primas, solventes ou excipientes. A Agence Nationale de Sécurité du Médicament et des Produits de Santé (ANSM) tem dois métodos baseados em HPLC-UV.18,19
A espectrometria de massa em tandem de cromatografia gasosa (GC-MS/MS) é outro método comumente empregado para a análise de nitrosamina. Ela oferece excelente sensibilidade e especificidade para a detecção de nitrosamina e é muito útil para nitrosaminas voláteis. USP <1469>,10 Taiwan FDA,13 e Swissmedic20 utilizam métodos GC-MS/MS para testes de nitrosaminas, e a Health Sciences Agency (HSA) de Singapura publicou um método baseado em cromatografia gasosa em massa de alta resolução precisa (HRAM-GCMS).21
Requisitos de filtração da amostra para análise de nitrosaminas
A maioria dos métodos mencionados acima requer filtração das amostras antes da injeção. A filtração é a maneira mais simples de remover partículas em amostras e fases móveis antes da injeção, o que pode afetar significativamente o desempenho de um instrumento de HPLC. As partículas são muito comuns em medicamentos como a valsartana, decorrentes do processo de dissolução da formulação. A classificação do tamanho do poro de um filtro de membrana determina até que ponto ele pode reter partículas em uma amostra, 0,45 µm é comum nos métodos de HPLC. Ao usar colunas embaladas com partículas pequenas (por exemplo, partículas abaixo de 2 µm) e ao usar UHPLC, recomenda-se um filtro de 0,2 μm. É importante observar que os filtros de membrana com a mesma retenção de poros nem sempre têm a mesma eficiência de retenção, conforme demonstrado em um estudo anterior.22
A Tabela 2 lista as etapas de filtração em métodos específicos publicados por agências reguladoras em todo o mundo. Para métodos analíticos de nitrosaminas, os filtros de seringa são o formato preferido. Dois atributos importantes dos filtros de seringa são o material do filtro de membrana e o tamanho do poro. PVDF e PTFE são os materiais filtrantes de membrana mais comuns referidos nos métodos analíticos publicados. Nylon e polipropileno hidrofílico (por exemplo, membrana GHP) também são mencionados em alguns casos (Tabela 2). Os tamanhos dos poros nos métodos são 0,2, 0,22 e 0,45 μm.
Métodos experimentais
O método USP <1469> Procedimento 3 previamente validado foi usado neste estudo.31 Parte 1 é um estudo sobre extraíveis de impurezas de nitrosamina de dispositivos de filtro de seringa e Parte 2 é um estudo de recuperação usando valsartana enriquecido. As condições LC-MS/MS são mostradas na Tabela 3 e as transições MRM são mostradas na Tabela 4.
Filtros de seringa testados. Três dispositivos para cada um dos dois lotes de (1) Millex® PVDF 0,22 µm e (2) Millex® PTFE 0,2 µm e três dispositivos para cada um dos lotes do (3) Fornecedor P PVDF 0,2 µm, (4) Fornecedor C H-PTFE 0,2 µm, (5) Fornecedor M PVDF 0,2 µm e (6) Fornecedor M PTFE 0,2 µm foram testados.
Parte 1 - extraíveis. Para determinar se havia níveis basais de extraíveis de impurezas de nitrosamina nos filtros de seringa, uma amostra de diluente apenas (0,1% de ácido fórmico v/v em água) foi enriquecido com quatro normas internas (NI) rotulados isotopicamente de acordo com USP <1469> [10 µg/mL para NDMA-d6 e NMBA-d3 e 1 µg/mL para NDEA-d10/NDBA-d18]. As amostras foram submetidas a vórtex, centrifugadas (10.000 rpm por 10 min) e o sobrenadante foi filtrado usando filtros de seringa de 13 mm. O filtrado foi analisado para seis compostos de nitrosamina usando LC-MS/MS. As concentrações foram determinadas usando-se uma curva de calibração externa de 1,33 - 90 ng/mL (NDMA, NMBA, NEIPA, NDIPA e NDBA) e 0,66-69,4 ng/mL (NDEA).
Parte 2 - Recuperação. 40 mg de valsartana dura (dose de 80 mg) foi pulverizada, diluída com 1% de ácido fórmico em água e enriquecido a uma concentração baixa (L2) de acordo com USP <1469>. A amostra foi então centrifugada, filtrada e analisada por LC-MS/MS.
Avaliação de filtros para análise de nitrosaminas
A filtração de amostras antes da injeção faz parte de muitos métodos baseados em LC-MS e GC-MS para testes de impurezas de nitrosamina. Garantir a ausência de extraíveis em dispositivos de filtração é essencial para manter a exatidão e a consistência dos dados nesses métodos. Além disso, é essencial conduzir estudos de recuperação, pois certas moléculas têm o potencial de se ligar aos componentes do filtro de seringa e, portanto, podem afetar a qualidade dos dados gerados.
Um método validado com base em USP <1469> Procedimento3 foi usado para avaliar filtros de seringa.27 Este método USP descreve o uso de LC-MS/MS para a quantificação de NDMA, NDEA, NDIPA, NEIPA, NMBA e NDBA em sartans selecionados (valsartana, losartana potássica, olmesartana medoxomila, candesartana cilexetila e telmisartana). A última parte da subseção "Solução da amostra" do método requer filtração "usando-se filtro de politetrafluoretileno hidrofílico (PTFE) com poro de 0,45 μm" após a centrifugação.11
Parte 1 – Extraíveis
O filtrado da etapa de filtração de seringa foi analisado para extraíveis de nitrosamina usando-se uma curva de calibração externa de 1,33-90 ng/mL (NDMA, NMBA, NEIPA, NDIPA e NDBA) e 0,66-69,4 ng/mL (NDEA). A Figura 1 é um exemplo de cromatograma MRM desses compostos.
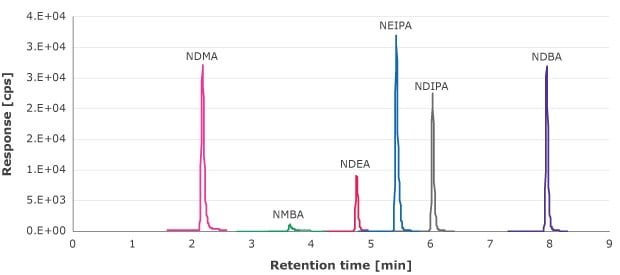
Figura 1.Cromatograma MRM das soluções padrão de nitrosamina. (10 ng/mL para NDMA, NMBA, NEIPA, NDIPA e NDBA e 6,6 ng/mL NDEA)
O limite de quantificação (LOQ) é definido como a concentração que fornece uma razão S/N de 10. A menor concentração das curvas de calibração para cada impureza de nitrosamina analisada teve S/N >10. Nenhuma nitrosamina foi detectada a ou acima desse valor em nenhum dos filtros de seringa testados (Tabela 5).
ABREVIATURAS: S/N = relação sinal/ruído, PVDF = fluoreto de poli(vinilideno) hidrofílico, PTFE = politetrafluoretileno hidrofílico, LOQ = limite de quantificação, ND = não detectado
Garantir que os dispositivos de filtragem não tenham extraíveis químicos que possam afetar negativamente a qualidade dos dados é essencial, especialmente com métodos que usam instrumentação altamente sensível. Deve-se evitar os extraíveis porque podem coeluir com picos de analito ou aparecer como picos inesperados nas análises a jusante (downstream), tornando a interpretação dos dados mais desafiadora. Os extraíveis podem vir da queda do filtro, de produtos químicos residuais do processo de fabricação ou de substâncias químicas secundárias lavadas do filtro. No caso de analitos específicos, como compostos de nitrosamina, os extraíveis podem ser inadvertidamente formulados durante o processo de fundição da membrana.
Parte 2 - Recuperação na valsartana
O estudo de recuperação foi realizado enriquecendo a amostra de valsartana com padrões de referência no nível de baixa concentração (L2). As soluções de amostra preparadas foram analisadas por LC-MS/MS, usando-se uma curva de calibração externa para calcular a concentração individual de analito. A razão entre o sinal padrão interno e o sinal do analito (por exemplo, sinal para NDMA-D6/sinal para NDMA) foi determinada na solução de amostra e nas soluções de calibração externas.
A Tabela 6 mostra a recuperação média dos filtros de seringa PVDF e PTFE testados. Todas as recuperações do composto estavam dentro de uma faixa de variação aceitável de 70-130%31 para todos os dispositivos e materiais testados com algumas pequenas diferenças evidentes entre os compostos e o material do filtro. Por exemplo, o NDBA demonstrou recuperações relativamente baixas (ainda dentro da faixa aceitável), potencialmente devido às suas interações hidrofóbicas com o meio do filtro ou ingredientes no medicamento. Os filtros de seringa de PVDF hidrofílico e PTFE Millex® mostraram recuperações consistentes lote a lote.
A ligação de moléculas de analito no dispositivo de filtração é outro fator a ser considerado ao escolher os materiais do filtro de seringa, pois a ligação pode levar a recuperações ruins. As propriedades físico-químicas do dispositivo de filtração (o filtro de membrana e o invólucro) e a química do analito determinam a extensão da ligação. Várias interações secundárias, como interações eletrostáticas, ligação de hidrogênio e interações hidrofóbicas, contribuem para a ligação do analito no filtro de membrana e no invólucro.32 Neste estudo, as recuperações relativamente mais baixas para NDMA usando-se filtros de membrana de PVDF e PTFE (ainda dentro da faixa aceitável) podem ser o resultado de interações hidrofóbicas entre a NDMA e a membrana. O NDIPA teve recuperações mais baixas com as membranas de PVDF, indicando que a molécula pode interagir de forma diferente com polímeros de PTFE versus PVDF. Outros polímeros com grupos funcionais polares e tendências de ligação não específicas mais altas, como o nylon, provavelmente demonstrariam uma ligação maior e, portanto, perdas mais altas de analitos. Para recuperações mais precisas, sugere-se, portanto, descartar o primeiro mL do filtrado durante a preparação da amostra, como a recomendação dada nos métodos da FDA dos EUA para o teste de nitrosaminas.23,24 Isso garante que os locais de ligação sejam saturados com analito para não causar perda adicional de analito. Observamos esse fenômeno até mesmo em materiais de membrana de ligação elevada, como náilon.
Teste de impurezas de nitrosamina e seleção de filtro
Todos os filtros de seringa de PVDF e PTFE testados demonstraram níveis de extraíveis de nitrosamina abaixo do limite de quantificação de acordo com USP <1469> Procedimento 3. Além disso, todos eles forneceram recuperações aceitáveis de analitos de nitrosamina enriquecidos, mostrando apenas pequenas diferenças para compostos diferentes. Isso demonstra a adequação desses meios de filtro para uso na preparação da amostra para métodos analíticos de nitrosamina.
Aplicações relacionadas
- Análise e controle de qualidade (CQ) de moléculas pequenas
A análise e o controle de qualidade (CQ) de moléculas pequenas em conformidade com as especificações farmacopeicas internacionais são fundamentais no desenvolvimento de medicamentos. Os testes microbianos e de química analítica asseguram que moléculas pequenas sejam desenvolvidas e fabricadas de acordo com as boas práticas de fabricação (BPF).
- Testes compendiais e orientação regulatória
Os testes de compêndio são essenciais para a liberação de excipientes e produtos farmacêuticos. As farmacopeias internacionais, como a USP e a EP, estabeleceram padrões de qualidade. Os testes e a conformidade com essas normas detalhadas nos métodos compendiais são requisitos básicos para ingredientes farmacêuticos e medicamentos.
Referências
Para continuar lendo, faça login ou crie uma conta.
Ainda não tem uma conta?