A1153
Aprotinin
3-8 TIU/mg solid, lyophilized powder
Synonyme(s) :
BPTI, Inhibiteur de la trypsine pancréatique bovine, Inhibiteur de trypsine (basique), Trasylol
About This Item
Produits recommandés
product name
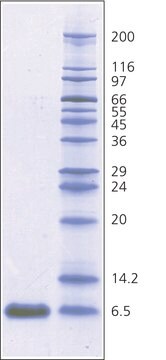
Aprotinine from bovine lung, lyophilized powder, 3-8 TIU/mg solid
Source biologique
bovine lung
Forme
lyophilized powder
Activité spécifique
3-8 TIU/mg solid
Poids mol.
~6,500
Solubilité
H2O: ≥5 mg/mL
Numéro d'accès UniProt
Température de stockage
2-8°C
Clé InChI
ZPNFWUPYTFPOJU-UHFFFAOYSA-N
Informations sur le gène
cow ... PTI(404172)
Vous recherchez des produits similaires ? Visite Guide de comparaison des produits
Description générale
Application
- Comme inhibiteur de protéases dans un tampon d'analyse par radioimmunoprécipitation (RIPA) pour l'homogénéisation de cellules endothéliales microvasculaires cardiaques (CMEC)(4) et de cellules épithéliales mammaires
- Dans une étude sur l'angiogénèse de fibroblastes
- Pour la stabilisation protéomique d'un surnageant salivaire
Actions biochimiques/physiologiques
Définition de l'unité
Notes préparatoires
Souvent commandé avec ce produit
Code de la classe de stockage
11 - Combustible Solids
Classe de danger pour l'eau (WGK)
WGK 1
Point d'éclair (°F)
Not applicable
Point d'éclair (°C)
Not applicable
Équipement de protection individuelle
Eyeshields, Gloves, type N95 (US)
Certificats d'analyse (COA)
Recherchez un Certificats d'analyse (COA) en saisissant le numéro de lot du produit. Les numéros de lot figurent sur l'étiquette du produit après les mots "Lot" ou "Batch".
Déjà en possession de ce produit ?
Retrouvez la documentation relative aux produits que vous avez récemment achetés dans la Bibliothèque de documents.
Les clients ont également consulté
Articles
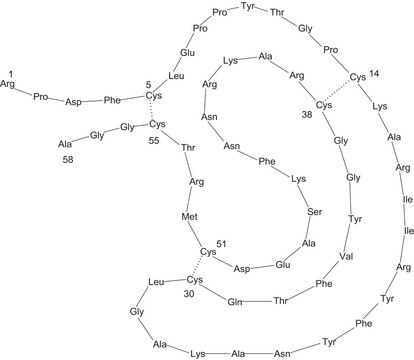
While aprotinin and bovine pancreatic trypsin inhibitor (BPTI) are the same protein sequence, the term aprotinin is typically used when describing the protein derived from bovine lung.
Elastase application index for understanding leukocyte elastase, a 29KDa serine endoprotease.
ReadyShield® phosphatase and protease inhibitor cocktail FAQ for sample protection in a variety of cell types and tissue extracts, including mammalian, plant, and microbial samples. Our ReadyShield® Protease Inhibitor Cocktail is a non-freezing solution that contains inhibitors with a broad specificity for serine, cysteine, acid proteases and aminopeptidases.
Analytical Enzyme Chymotrypsin: Chymotrypsin is produced in the acinar cells of the pancreas as the inactive precursor, chymotrypsinogen.
Protocoles
Objective: To standardize a procedure for the enzymatic assay of Aprotinin.
Notre équipe de scientifiques dispose d'une expérience dans tous les secteurs de la recherche, notamment en sciences de la vie, science des matériaux, synthèse chimique, chromatographie, analyse et dans de nombreux autres domaines..
Contacter notre Service technique