MABS157
Anti-O-verknüpfter-N-Acetylglucosamin-Antikörper, Klon RL2
clone RL2, from mouse
Synonym(e):
O-Linked N-Acetylglucosamine
About This Item
Empfohlene Produkte
Biologische Quelle
mouse
Qualitätsniveau
Antikörperform
purified immunoglobulin
Antikörper-Produkttyp
primary antibodies
Klon
RL2, monoclonal
Speziesreaktivität (Voraussage durch Homologie)
all
Methode(n)
affinity binding assay: suitable
electron microscopy: suitable
immunocytochemistry: suitable
immunoprecipitation (IP): suitable
western blot: suitable
Isotyp
IgG1κ
Versandbedingung
wet ice
Posttranslationale Modifikation Target
unmodified
Angaben zum Gen
human ... OGT(8473)
Allgemeine Beschreibung
Spezifität
Immunogen
Anwendung
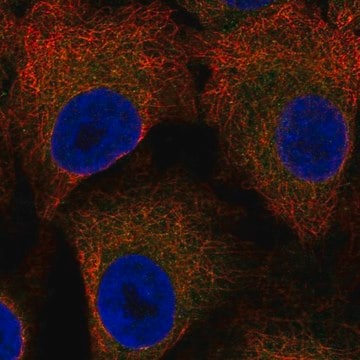
Immunzytochemische Analyse: Mit einer repräsentativen Charge wurden die Kernhüllen aber nicht das Kerninnere von mit Digitonin permeabilisierten HeLa-Zellen immungefärbt. Klon RL2 färbte das Kerninnere nur bei mit Triton X-100 permeabilisierten HeLa-Zellen ohne intakte Kernhüllen (Adam, S.A., et al. (1990). J. Cell Biol. 111(3):807–816).
Affinitätsbindungsassay: Eine repräsentative Charge wurde mit 125I radioaktiv markiert und ihre Bindungseigenschaften gegenüber isolierten Kernhüllen aus der Rattenleber wurden untersucht (Snow, C.M., et al. (1987). J. Cell Biol. 104(5):1143–1156).
Elektronenmikroskopie: Mit einer repräsentativen Charge wurde die Immunreaktivität von O-GlcNAc in isolierten Kernhüllen aus der Rattenleber lokalisiert (Snow, C.M., et al. (1987). J. Cell Biol. 104(5):1143–1156).
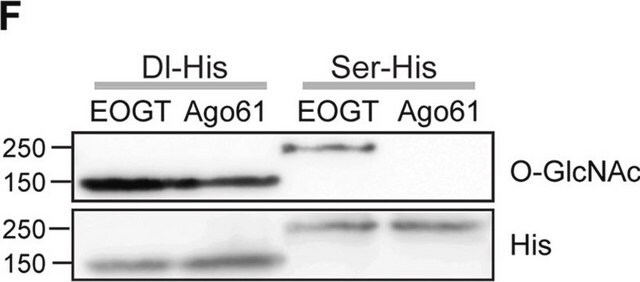
Western-Blot-Analyse: Mit einer repräsentativen Charge wurden O-GlcNAcylierte Proteine in Kernhüllenpräparaten aus der Rattenleber nachgewiesen (Snow, C.M., et al. (1987). J. Cell Biol. 104(5):1143–1156; Holt, G.D., et al. (1987). J. Cell Biol. 104(5):1157–1164).
Analyse mittels Immunpräzipitation: Mit einer repräsentativen Charge wurden O-GlcNAcylierte Proteine aus solubilisierten Kernhüllenpräparaten aus der Rattenleber mittels Immunpräzipitation ausgefällt. Die Vorbehandlung der Kernhüllenpräparate mit Galactosyltransferase verhinderte die Immunpräzipitation von Glykoproteinen durch Klon RL2 (Snow, C.M., et al. (1987). J. Cell Biol. 104(5):1143–1156; Holt, G.D., et al. (1987). J. Cell Biol. 104(5):1157–1164).
Qualität
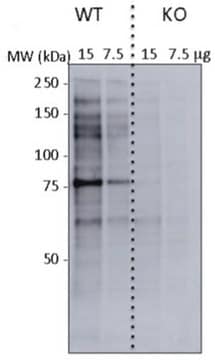
Western-Blot-Analyse: Mit 1,0 µg/ml dieses Antikörpers wurde O-verknüpftes N-Acetylglucosamin in 10 µg HeLa-Zelllysat nachgewiesen.
Zielbeschreibung
Physikalische Form
Sonstige Hinweise
Not finding the right product?
Try our Produkt-Auswahlhilfe.
Lagerklassenschlüssel
12 - Non Combustible Liquids
WGK
WGK 1
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.