釋放 O 連結聚糖或 O-聚糖可能涉及各種步驟,包括使用外糖苷酶移除不同的非還原末端殘基。請繼續閱讀,瞭解 O-連結聚糖的策略,例如 O-糖苷酶的作用,以及如何去除二、三氨酰化、β-連結半乳糖和 N-乙醯葡萄糖胺。O-糖苷酶
N 連結寡糖可使用 PNGase F 移除,但在移除完整的 O 連結糖方面,沒有任何酵素可與 PNGase F 相提並論。O-Glycosidase (也稱為 Endo-α-N-acetylgalactosaminidase 或 O-Glycanase) 會水解絲氨酸或蘇氨酸連結的未取代 O-glycan 核心 [Gal-β(1→3)-GalNAc](圖 1)。核心結構的任何修改都會阻礙 O-糖苷酶的作用。為了避免這個問題,可以使用外糖苷酶(如sialid酶)在O-糖苷酶處理之前或同時將糖型還原為核心結構。
![O-Glycosidase Cleavage Site 圖示 O-糖苷酶的裂解位點和結構要求,O-糖苷酶可水解與絲氨酸或蘇氨酸連結的未取代 O-聚糖核心 [Gal-β(1→3)-GalNAc]。](/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/articles/research-and-disease-areas/cell-signaling/o-glycosidase/o-glycosidase.jpg)
圖 1.O 型糖苷酶的裂解位點和結構要求。任何對核心結構的修改都會阻止裂解。
單糖必須依序經由一系列外糖苷酶水解,直到只剩下 Gal-β(1→3)-GalNAc 核心為止。O-Glycosidase (ex. 324716)接著可以移除完整的核心結構,而絲氨酸或蘇氨酸殘基則不會被修飾。1糖蛋白的變性似乎不會顯著增強O-脫糖基化。
化學釋放
O-聚糖的化學釋放通常包括製造鹼性條件,以產生 β-消除反應來釋放 O-聚糖。然而,由於苛刻的鹼性條件,有時候釋放的 O-聚糖會在通常所說的「剝離反應」中進一步降解。為了減輕這些影響,GlycoProfile™ Portfolio EZGlyco® O-Glycan Prep Kit 使用高活性胺和有機超級碱來獲得高回收率,並將「剝離」減至最低。本試劑組還包含所有必要試劑,可在 5 小時內輕鬆完成 O-糖樣品製備。
去除鍵合酸殘基
核心 Gal-β(1→3)-GalNAc最常見的修飾是單(mono)、二(di)或三(trisialylation)。2,3,4,5這些半乳醯酸殘基很容易被α-(2→3,6,8,9)-神經醯胺酶(ex.N8271),因為只有這種酵素能夠有效地裂解 NeuAc-α(2→8)-NeuAc鍵(圖 2)。
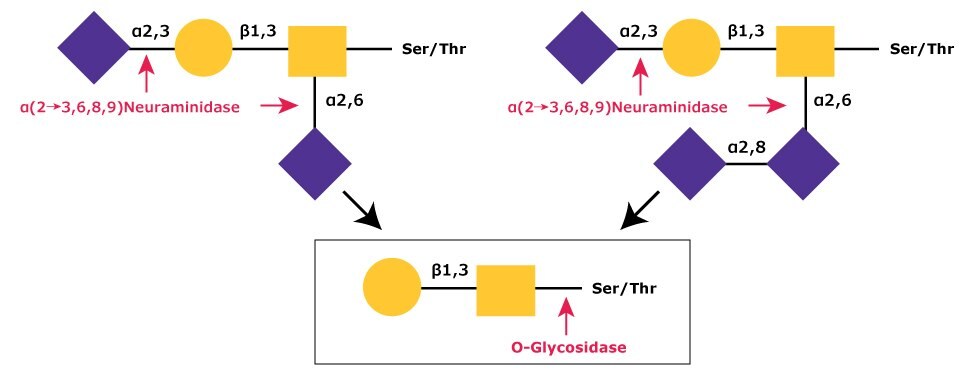
圖 2.在順序的糖化裂解過程中,二ialylated 和三ialylated O-連結的聚糖會被α-(2→3,6,8,9)-neuraminidase移除sialic acid residues (NeuNAc)。然後,核心 1 型聚糖會被 O-糖苷酶從 O-連結處裂解。
β鏈結半乳糖和N-乙醯葡萄糖胺
另一種常見的 O 連結六糖結構包含 β(1→4)- 連結的半乳糖 (Gal) 和 β(1→6)- 連結的 N-乙醯葡萄糖胺 (GlcNAc) 以及矽酸。7,8水解這種聚糖除了需要神經氨酸酶外,還需要β(1→4)特異性半乳糖苷酶(ex.A6805)(圖 3)。非特异性半乳糖苷酶(ex.G5635)會水解核心聚糖中的β(1→3)-半乳糖,並留下無法被O-糖苷酶去除的O-連鎖GalNAc殘餘物。

圖 3.Disialylated O-linked Core 2 hexasaccharide is sequentially degraded by (1) removal of sialic acid residues (NeuNAc) using α(2→3,6,8,9) neuraminidase, (2) removal of β(1→4)-半乳醣 (Gal) 殘基,使用 β(1→4)- 半乳糖苷酶;以及 (3) 使用 N- 乙酰葡糖胺苷酶去除 N-乙酰葡糖胺 (GlcNAc)。如 圖 2. 所示,剩餘的核心 1 型聚糖就可以使用 O-糖苷酶從 O-連結中裂解出來。

圖 4.含有 β(1→4)-linked galactose (Gal) 和 β(1→6)-linked N-acetylglucosamine (GlcNAc) 的 O 連結六糖結構,以及二和三叉化的 O 連結聚糖。
其他 O-連鎖寡糖修飾
在 O-連鎖寡糖上發現的較少見的修飾包括 α-連鎖半乳糖 (Gal) 和 α-連鎖岩藻糖。8.9 α-Gal 已被發現是動物組織中常見的過敏原,可導致肉類過敏或異種移植免疫原性。 10 非特異的α-半乳糖苷酶 (ex. G8507)可用來水解此類連結。直接連接到肽骨架的 N-乙醯葡糖胺(在核蛋白上發現)和 α 連接的 N-乙醯半乳糖胺(在黏蛋白中發現)也有報導。11 當這些殘基存在時,額外的外糖苷酶對於完整的 O-去糖基化是必要的。目前無法以酵素方式去除直接與蛋白質 O-連結的岩藻糖和甘露糖。 12,13
Network error: Failed to fetch
在此找到更多技術資源: Glycobiology
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?為便利客戶閱讀,此頁面中文以機器翻譯完成。雖然我們已盡力確保機器翻譯的準確性,但機器翻譯並非完美。如果您對機器翻譯的內容不滿意,請參考英文版本。