閱讀更多資訊
- 用於 ICC 的螢光免疫檢測:步驟說明
- 選擇螢光劑時的其他考量
- 螢光保護計劃:延長螢光抗體和試劑的使用壽命
- 抗體選擇:染色技術
- 抗體選擇:針對目標、特異的反應性
- IF-ICC的實驗控制
- 使用 IF-ICC 獲得最佳信號和征服背景的內幕建議
- 相關產品
使用螢光抗體進行免疫著色
免疫螢光(IF)的用途--IF-ICC免疫螢光 (IF) 的用途包括蛋白質定位、確認轉譯後修訂或活化,以及接近其他蛋白質或與其他蛋白質複合。免疫細胞化學(ICC)是一種成熟的技術,它使用抗體與細胞樣本中的目標結合,Coons et al 在 1942 年首次描述了使用螢光報告分子進行免疫檢測。 在本指南中,抗體科學家分享了我們從 IF-ICC 實驗中獲得最佳圖像的心得。
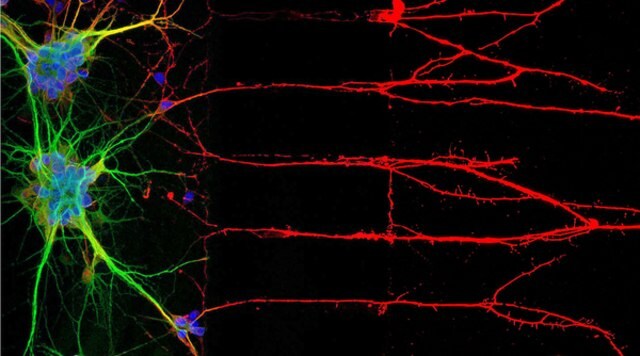

圖 1:免疫細胞化學 (ICC) 定位與神經細胞核、神經體和神經軸(左)相關的蛋白質。右圖為人類細胞株 U-251 MG 的免疫螢光染色。

圖 2.螢光免疫檢測
可能需要優化免疫螢光方案的某些步驟,以便根據包括目標的亞細胞位置和抗原特徵等因素獲得最佳結果。
樣本製備:
不論細胞生長形式如何,成功的 IF-ICC 成像都是從以適當的培養密度採集健康樣本開始。
懸浮細胞:
細胞類型可以洗滌以去除培養基,並重新懸浮,然後在小容量管中染色,再安裝到玻片上進行顯微鏡檢查。 懸浮液應首先在顯微鏡下檢查形態,並且不應超過細胞系的推薦匯合/滴度,才能被視為適合進行免疫細胞化學。健康的亞匯合培養物不會過度混濁,也不會出現黃變,顯示培養基酸化。可用血球計及胰藍排除法測定存活率。洗滌後,細胞應以 1 -2 x 106 細胞/毫升的量重懸,無論是在溶液中進行 ICC 染色,還是在經過特殊處理以增強細胞黏附性的玻片上進行後續染色的塗片應用。
當 黏附細胞 被培養(或許被處理)以檢查 IF-ICC 對目標表達的影響時,細胞可能會被接種到 腔室玻片上,腔室玻片是專為光學成像而優化的玻片,附有單腔室或多腔室上層結構,允許添加培養基進行培養。粘附的細胞類型也可以接種到浸在培養基填充孔中的顯微鏡玻片蓋玻片上,隨後將其染色並安裝到玻片上進行成像。
無論採用哪種培養表面和容器方式,都應仔細觀察蓋玻片上或玻片室中的細胞生長情況,以便在細胞過度生長之前將其從培養物中取出並固定,以進行免疫細胞化學研究。 細胞通常在融合度(細胞覆蓋的表面面積)在 50-80% 的範圍時成像。 如果必須在免疫染色之前確定細胞的存活率,有些研究人員會使用染料,例如 ethidium homodimer 。因此,用 DAPI(可在有活力和無活力的細胞核中發出螢光)進行成本染色,可以幫助量化活力百分比,即乙啶染色的細胞核數目/雙重染色的細胞核數目。另外,也有商品化的活/死細胞試劑盒,通常使用鈣化鋅和碘化丙啶分別區分活細胞和死細胞。
固定:
固定和透化可使用酒精和丙酮等有機固定劑一步完成。然而,當脂質的完整性必須維持時,如目標抗原與膜相關時,則不應使用有機溶劑。 雖然甲醛(通常以聚合形式 多聚甲醛 "出售和使用)是一種常用的選擇,它可以阻止分解並將蛋白質固定在原位,但交聯醛會妨礙抗體接觸某些抗原,因此應在 10-20 分鐘孵育後以有效保留結構的最低濃度使用,(多聚甲醛)通常在 1-4% 之間。 注意: 因為它是自發螢光的來源,所以在 IF 固定方案中最好避免使用戊二醛。
抗原擷取:
某些目標表位可能會因為複合在擠迫的細胞微環境中或固定技術而被遮蔽。 抗原擷取 技術已經證實能夠提高抗體對某些抗原靶點的獲取能力,但在使用玻片上的細胞時應格外謹慎,並進行預先測試,因為這些技術使細胞暴露於的熱或化學條件通常對 ICC 樣本而言太苛刻。
滲透:
Triton-X或Tween-20洗滌劑常用於有效地透化固定細胞,但這些洗滌劑不加區分地溶解脂質,其破壞性可能比皂苷(一種植物性糖苷,通過選擇性溶解膽固醇來穿孔膜,使細胞器膜基本保持完整)更大。如果感興趣的目標位於細胞內的膜結合結構中,較強的去垢劑如 Triton-X、Tween-20、Brij 去垢劑或 NP-40 較可能提供抗體進入的機會。皂素是一種較溫和的滲透劑,可保持表面抗原的完整性,但可能不適合滲透細胞內膜,以提供抗體進入細胞核或其他細胞器內的靶點。由於皂素的作用可能是可逆的,因此洗滌後會消失,因此在整個染色過程中都應使用皂素,以確保抗體能被接觸到。
阻斷:
用高達 5%的正常血清溶液來培養二抗,可以有效阻斷二抗的非特異性結合。當沒有血清時,一種適用於任何二抗的方法是使用更通用的蛋白質阻擋劑,如PBS中類似稀釋的牛血清白蛋白(BSA)。有些實驗室使用血清和 BSA 的組合來達到抗體宿主特異性和一般阻斷的效果。BSA 通常是凍乾後再造的液體,因此必須過濾及/或定期檢查是否有微粒沉澱在樣品上,造成染色假象。透過稀釋阻斷緩衝液中的抗體,可在整個免疫螢光方案中維持阻斷。
抗體與螢光團選擇
螢光團選擇
。在規劃任何利用 ICC 檢查細胞的螢光實驗時,首先應該考慮用來分析的顯微鏡的光學配置。 IF-ICC 協議可用於標記單一靶點,但許多螢光顯微鏡的配置可容納 多重染色,或同時染色多個靶點和細胞核。染色三個靶點和細胞核的實驗示例如下:
螢光顯微鏡在激發和發射方面有獨特的配置。 顯微鏡出廠時都配備了高強度光源,例如弧光燈或雷射,它們以特定波長發光,能夠激發相容的螢光團。濾光片組可捕捉激發螢光團所發出的光波長範圍,其範圍可以很寬以最大化所捕捉的發光,或很窄以最佳化特異性並減少發光通道重疊。上表是根據常見的螢光顯微鏡配置提供的範例。 請參考您的儀器雷射和濾光片配置,幫助您選擇最適合您的免疫螢光 ICC 或 IHC 方案的螢光團結合抗體。 顯微鏡核心科學家通常是 IF 實驗設計的有用資源。
選擇螢光團時的其他考慮因素
光穩定性:光漂白(Photobleaching),即螢光團因光線引起的不可逆損害,會影響其發出螢光的能力,可能是由於螢光分子過度曝露於環境光線下或在顯微鏡檢驗期間受到激發所致。許多無所不在的螢光團,例如 FITC 和 TRITC,由於它們是非專利的,也由於它們的市場壽命長,因此廣為人知,但它們對於光漂白的敏感度可能遠高於使用其他化學物質的後代螢光團。
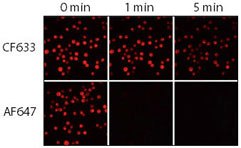
圖 3.CF633 和 Alexa Fluor 647 (AF647) 山羊抗小鼠結合物的相對光穩定性。將 Jurkat 細胞固定、透過化,並用兔抗 CD3 染色,然後用 CF633 或 Alexa Fluor® 647 羊抗兔 IgG 結合物染色。使用配備 Cy5 濾光片組和 CCD 相機的汞弧燈顯微鏡對樣本進行成像。在 0、1 和 5 分鐘時捕捉序列圖像。
在製作含有螢光探針的稀釋抗體工作溶液時,請考慮將此工作溶液稀釋在琥珀色小瓶等遮光容器中。工作溶液暴露在光線下的時間通常比儲存的儲備溶液或商用抗體預備液要長,因此這種減少光線暴露的額外措施可能會在使用場合中提供額外的保護:延長您的螢光抗體和試劑的使用壽命
螢光試劑可能需要特殊的儲存和處理,以保持螢光實體的光穩性以及抗體本身的功能完整性。確保試劑在供應商的運送文件中指定的任何溫度條件下運抵,並轉移至製造商建議的實驗室儲存,以免影響光線和溫度條件。到貨後,將抗體儲備液等分為較小的容量(並複製標籤),以限制儲備液暴露於凍融、冰桶變化或其他溫度變化或環境光線的次數,從而保護試劑的完整性。
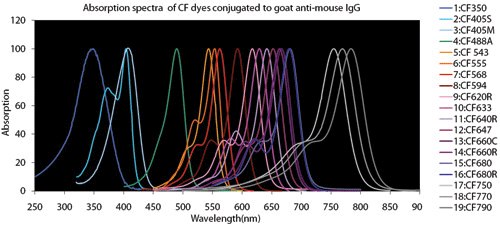
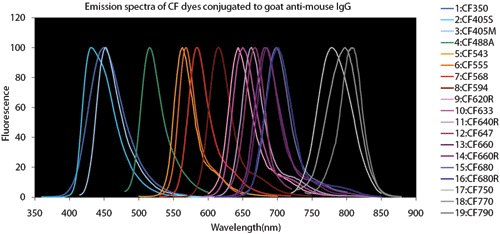
圖 4.螢光染料比較表
光譜重疊:進行多重實驗以檢測同一樣本中的多個目標時,請參考螢光團的光譜特性、雷射波長和顯微鏡濾光片範圍。應選擇顯微鏡發射濾光片配置以減少光譜重疊,但選擇沒有長發射 「尾巴 」的螢光團也是很好的做法,因為長發射 「尾巴 」可能會滲透到相鄰的濾光片通道。

圖 5.CF543 和 Alexa Fluor 546 (AF546) 山羊抗小鼠結合物的相對螢光與每個蛋白質的染料分子數量(標記程度)的函數。
抗體選擇:染色技術
抗體選擇
直接染色:有些研究人員可能會喜歡「直接染色」方法的便利性,也就是將一抗直接與螢光團結合,因為結合與螢光檢測只需一個步驟即可達成,而且完成 IF-ICC 方案所需的整體時間也會縮短。直接結合物也有助於同一樣本中多個靶點的多重染色,因為不需要選擇不同宿主的一抗以避免交叉反應(更多有關多重 IF-ICC 的資訊,如下)。
如果使用一抗結合物,這一步應在黑暗中進行,以保護螢光體免受光漂白。與一抗結合物孵育後,可立即進行清洗和裝片。可使用雞尾酒抗體在單一步驟中對樣本中的多個目標進行染色。
間接染色法:在「間接」免疫檢測中,針對目標的未標示的一抗接著檢測一抗的宿主種類的螢光團結二抗,此技術賦予信號放大的明顯優勢,因為有可能有多個含螢光團的二抗結合一抗,增加抗原部位的螢光發光分子數量。
同時針對同一樣本中的多種抗原進行多重靶向檢測,需要額外考慮間接檢測方法,說明如下。
抗體選擇:靶上、特異的反應性
第一抗體:
在間接檢測過程中,抗體將應用在多重實驗的雞尾酒中,在一抗和二抗孵育步驟中都是如此。因此,為每個目標選擇在不同宿主中培養的一抗是非常重要的,這可確保二級雞尾酒中的每種共抗都能與樣品中獨特的一抗結合。如果不能為每個目標抗體選擇獨特的宿主,將導致無法解釋的染色結果。 以下是多重間接檢測的實驗示例:
在這個例子中,如果研究者選擇了兔抗B一抗,抗A和抗B都會被抗兔二抗結合物靶向,靶A和靶B都會被綠色螢光信號標記。
一抗-組織交叉反應: 當選擇抗體進行間接染色時,建議取消選擇任何在與樣本來源相同的宿主中提出的一抗--例如,不要在小鼠組織上使用小鼠一抗 與抗小鼠二抗結合可能會導致二抗直接與組織廣泛結合,造成顯著的背景染色。注意:對於直接染色方法,宿主與自身的交叉反應通常不是問題。
二抗:
正如上文(抗体选择:染色技术,间接法,上文)所解释的,「间接」IF-ICC使信号放大成为可能,因为多个二抗可能与结合到靶上的一抗结合。但是間接 IF-ICC 也允許實驗室建立一個模組化的 二抗 庫,與不斷增加的一抗相容,因此任何靶點都可以分配到任何可用的顯微鏡濾光片通道。
清洗:
每次使用抗體或其他螢光探針後進行清洗,以消除樣品中結合親和力較低的抗體,從而減少非特異信號或交叉反應。 PBS 中清洗幾分鐘,並至少交換兩次緩衝液,將有助於消除樣品中未結合和鬆散結合的抗體。
較長時間的清洗可能不會帶來明顯的降低背景的好處,但只要在緩衝液中的較長時間不會使樣品脫離玻片或蓋玻片,則通常不會有害。 非常短的、重複次數較少的洗滌可能無法有效地去除沒有特異性結合到靶點的抗體,這可能會導致信號:背景比較差。
核反染色和裝片:
許多進行 IF-ICC 的研究人員可能希望使用標記細胞核的螢光試劑,例如 DAPI 或 Hoechst。 由於這兩種試劑在接觸到 DNA 的幾秒鐘內就會夾雜螢光, 含有 DAPI 的裱裝介質可以用來在單一步驟中實現核染色和裱裝。
所有的掛載培養基都有助於將蓋玻片固定在玻片上,並通過防止脫水來保存顯微鏡檢測的樣品。許多安裝媒體的配方也能優化顯微鏡檢查的折射率,並可能含有保護染色樣品上結合的螢光團免受光漂白的成份。
IF-ICC的實驗控制
與其他實驗一樣,包含陽性和陰性對照可增強對螢光 ICC 結果靈敏度和特異性的信心。
IF-ICC實驗的對照可能包括:
省略一抗:
在任何ICC實驗中都可以很容易地加入一個簡單的對照,那就是在間接免疫檢測方案的一抗染色步驟中省略一抗。
同型对照:
对于用共轭一抗直接染色,用与相同荧光团共轭的同型对照替代一抗共轭物,有助于确保观察到的任何信号都是由于一抗对抗原的特异性所致。同型對照通常可以從抗體結合物的供應商那裡買到,它們與抗原抗體屬於同一種類和免疫球蛋白類型,但對任何已知的表位都沒有特異性。
同型對照可以作為一抗的對照,因為它們的加入證明了觀察到的任何信號不是由於一抗蛋白本身的 「粘性」。
對目標抗原陰性的細胞:
已知一種細胞類型不表達所關注的抗原,可以作為陰性對照樣品。 另外,如果有可用的話,經基因改造的目標細胞(knock-out 細胞)可以作為目標特異性的可靠對照。基因改造技術,例如 CRISPR/Cas 核酸酶 可以用來剔除目標蛋白的表達,以建立陰性控制細胞系。
目標抗原陽性的細胞:
如果有先前已證實能表達所需抗原的細胞,無論是內源表達或經由「敲入」或過度表達基因的改造,這些細胞可作為陽性對照,以確認當樣本中存在目標抗原時,染色方案會產生信號。
Insider Advice for Getting the Best Signal-and Conquering Background-with IF-ICC
- 在可能的情況下,選擇那些有數據的抗體。在可能的情況下,選擇在 ICC 應用中有數據證明結果的抗體
- 使螢光抗體的光譜特性與顯微鏡激光器和濾光片相匹配
- 固定健康、無污染、無沉澱物和近融合的細胞樣品
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?