缺氧檢測分析
組織和細胞中氧氣含量的測量
缺氧被定義為組織中的氧氣不足,缺氧是原發性腫瘤的一個特徵,它的發生是由於組織和細胞中的氧氣含量減低所致&。nbsp;癌細胞的呼吸需求增加。由於毛細血管集中在周邊,腫瘤微環境會產生氧梯度,壞死核心附近[O2]低,腫瘤表面[O2]高(圖 1)。缺氧會影響轉移性疾病的許多方面,包括細胞增殖、新陳代謝能力、免疫反應以及對化療干預的抵抗力。在細胞層面上,低氧反應是由低氧誘導轉錄因子(hypoxia-inducible (HIF) transcription factors)所介導,這些因子調節基因表達,驅使駐留細胞適應。闡明低氧反應的基本機制,對於開發針對腫瘤進展的治療藥物至關重要。我們提供各種缺氧檢測試劑盒和分析方法,以測量固定和活細胞及組織中的氧含量。

圖 1.缺氧的腫瘤微環境。實體腫瘤會迅速擴大血液供應,使得腫瘤區域的氧濃度遠低於健康組織。低氧環境會導致癌細胞突變率增加、藥物外流、迴避凋亡,以及整體細胞增殖、藥物溶解度、可溶性細胞因子和營養素分泌減少。
EF5缺氧檢測試劑盒的主要優點:
- 與pimonidazole不同,單一親脂性EF5形式 有利於快速、均勻的組織分佈
- 校準 EF5 結合影像可提供每個細胞的定量 pO2 值
- 在超過 2000篇出版物

圖 2.固定組織中的缺氧檢測。顯示 EF5 結合(紅色,圖 A & B)與血管(綠色,CD31;圖 A)或增殖細胞(綠色;Ki67 - 圖 B)之間關係的人體皮膚。
圖 3.BioTracker 低氧染色機理。在缺氧條件下,BioTracker 520 Green Hypoxia Dye 中的偶氮基會發生還原裂解,產生 2Me RG,發出明亮的綠色螢光。較低的氧含量(更嚴重的缺氧條件)會導致更高的螢光強度。

圖 4.癌細胞缺氧的測量。使用 BioTracker 520 Green Hypoxia Dye 對氧濃度下降的 A549 活細胞進行螢光成像。

圖 5.使用流式細胞計檢測缺氧。A549 細胞在不同氧濃度下孵育 6 小時後,使用 1 μM BioTracker 520 綠色缺氧染料染色,並以流式細胞計法進行分析。螢光強度隨氧濃度降低而增加,顯示該染料是使用流式細胞儀偵測缺氧的可行探針。
低氧微環境的微流控
The CellASIC成像平台可在單一裝置中控制培養基灌注、氣體交換和溫度,以進行自動、長期的細胞培養和連續的活細胞成像。這種創新設計允許細胞透過加壓流道暴露在不同的環境條件下,並控制培養參數,用戶可指定改變培養基來源和流速。
培養單元由微流體板和環境控制系統組成(圖 6)。板的結構採用透氣材料和通氣通道,將擴散效應降至最低。微量培養可實現更精確的化學時間和空間控制,包括快速改變實驗條件。控制器可調節加壓細胞裝載、可程式培養基灌注、溫度和氣體水平。由於其小巧的尺寸和高光學清晰度,平板可搭配大多數倒置顯微鏡進行自動動態分析。當與螢光可視化結合時,ONIX2 可用於監測標籤 蛋白質表達的變化(圖 7 和圖 8),並同時分辨和分析多種細胞類型。
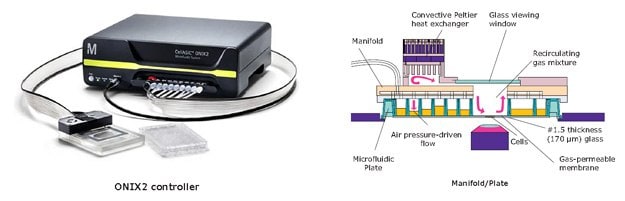
圖 6.CellASIC


圖 7.化學抗性平行改變 HIF1α 蛋白水平。A) 在低氧調節和常氧重建期間,固定細胞並染色以識別總細胞和低氧反應部分。B) Hif1α 水平與化學抵抗力的變化相關,在低氧暴露時間延長到 4 小時時達到峰值。總細胞(DAPI)和低氧反應部分(Hif1α)的歸一化螢光強度(兩張圖片均為 20X)。

圖 8.癌細胞株的低氧反應將八個來自不同組織來源且具有不同轉移潛力的癌症細胞株(MDA-MB-231、M4A4、MCF7、HT1080、A549、A431、HeLa、HCT116)預先處理為缺氧狀態(無論是否重新建立標準氧含量),並曝露於細胞毒性藥物 Staurosporine(STX)。
結論
已知缺氧會影響多種腫瘤細胞功能和過程,包括細胞增殖、對細胞毒性藥物的抵抗力、細胞死亡機制和轉移潛力。進一步闡明缺氧機制和過程,將可讓研究人員預防癌症惡化,並開發更有效、更穩健的化療藥物。無論您採用何種實驗方法,我們都致力於透過加速創新方法和材料的取得,協助您解決生命科學中最棘手的問題。從固定組織到活細胞成像,我們提供的試劑、工具和儀器可加速您對癌症和其他疾病狀態中缺氧的研究。
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?