生物製程中的生物負荷控制
生物負荷控制是成功製藥的關鍵,製程上游或下游的污染事件可能導致重大的中斷和成本。全面思考污染控制、識別製程中的關鍵點,以及將污染風險降至最低的緩解措施,是污染控制策略和成功製程的基礎。
生物負荷控制在上游製程與下游製程中有何不同
上游製程
在上游製程中,生物負荷控制的重點在於原料的採購與特性分析,以防止細胞培養作業中引入外來物質。這些製程通常是無菌的;而細胞培養基質通常會先經過過濾器處理,去除細菌和支原體,然後才將培養基質導入製程。快速檢測方法有助於確保受污染的採收前材料不會轉移到下游製程中。1
下游製程
Most 單株抗體療法的下游作業不被視為無菌作業,並以「低生物負荷」或「生物負荷控制」的方式運作。製造商通常會自行設定生物負荷等級。
有效控制生物負荷的三種方法:
有效生物負荷控制的三種方法:評估、減輕、監控
有效的生物負荷控制策略依賴於三種互補的方法:
- 評估生物負荷
- 降低發生的風險
- 持續監控以確保製程控制
Assess Your Bioburden Risks
Assessing the microbial profile of a process is the first step to evaluating risk; understanding which microbial contaminants are present and how many (ex:原材料測試)提供了一個基線,可作為未來營運的基準。風險評估工具可用於嚴格評估上游和下游製程的各個環節,以確定污染物的潛在影響。3 此方法是根據國際協調委員會文件 ICH Q9 的建議而制定。4 全面的品質風險管理 (QRM) 策略依賴於科學的方法,既能了解風險,又能排定緩解措施的優先順序。
由於營養豐富的環境是微生物繁殖的理想環境,因此上游製程的污染風險很高。在接近最終產品的加工步驟中,風險也很高,因為去除微生物的淨化步驟較少,對產品品質和病患安全的潛在影響也較大。然而,在中間處理步驟中,由於緩衝劑和消毒劑較不適合微生物生長,因此污染風險較低。在整個生物製造作業中,這種不同的風險敏感度被形容為「風險吊床」,在思考風險緩解時會有所幫助 (Figure 1)。
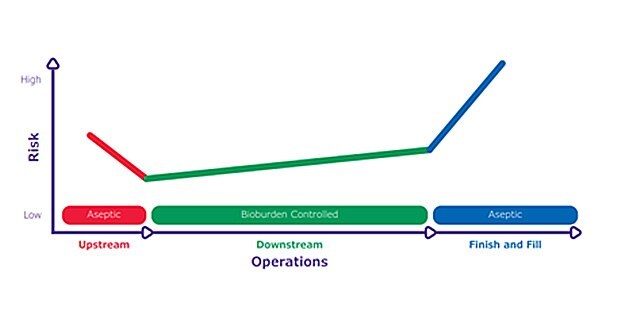
圖 1.風險吊床」突顯了生物製造中不同的風險敏感度。上游作業是無菌作業,污染風險高。下游作業控制生物負荷,污染風險較低。完成與填充步驟是以無菌方式執行,任何污染對病患安全的風險最高。
微生物污染物進入下游製程的潛在途徑有許多:不當的清潔或消毒、有風險的無菌連接、未達到最佳的系統設計,以及無菌技術的疏漏。
儘管中間處理步驟的污染風險較低,但並非零。某些中間處理步驟涉及多次重複使用的元件,例如層析樹脂和切向流過濾裝置。通常情況下,這些元件無法進行消毒,因此需要進行滅菌以將生物負荷降至最低。不幸的是,填料層析柱為微生物生長和生物膜形成提供了理想的環境。蛋白 A 層析柱的問題尤其嚴重,因為它是第一個純化步驟,載有營養豐富的物質,有助於微生物生長。再加上許多有效的消毒解決方案都會對樹脂性能造成負面影響,因此 蛋白質 A 擷取步驟 對微生物控制而言特別具有挑戰性。
降低生物處理過程中的生物負荷風險
降低生物負荷風險有賴於材料控制、設施清潔和消毒、密封以及使用過濾去除污染物。防止微生物進入生物製藥生產流程,首先要從生產所需的原料,並仔細考慮產地、供應商和供應商的品質管理系統。此外,供應商的材料特性和建議品質等級(請參閱我們的M-Clarity™ Program)可能會影響使用前的處理和加工,甚至導致更換供應商。
在無法選擇無菌操作的中間處理步驟中,消毒劑尤其重要。 就地清洗衛生處理可減少但無法消除生物負荷,並可能增加微生物細胞碎片的含量,例如細菌衍生的疏水性脂多醣分子(內毒素)。因此,透過密閉和過濾來降低生物負荷,而非僅依賴消毒來殺滅微生物,通常是有益的做法。
密閉裝置如single-use assemblies。/language-masters/zh_tw/products/pharma-and-biopharma-manufacturing/fluid-management/connection-disconnection-for-bioprocessing">消毒流體傳輸系統連接製程步驟之間的一次性流體路徑,將微生物侵入減至最低,而且由於它們是預先消毒的,因此應該不會造成生物負荷水平。同樣地,封閉式取樣技術可將污染物導入產品流路的風險降至最低。過濾是生物負荷控制的絕佳選擇,但在實施之前,應先建立並優化製程設計和操作最佳實務。任何一次性使用系統或過濾器都應與製程流體相容,並滿足生物負荷控制、製程效率和成本方面的性能需求。
生物負荷控制的過濾考慮因素
上游操作: 膜過濾器採用 0.1 µm 或 0.2 µm 的膜孔徑通常用於處理細胞培養基。過濾器的選擇基於處理成本、製造商經驗和風險承受程度。
中間下游操作: 可使用滅菌級或減少生物負荷過濾器。根據製造商的生物負荷概況及其風險評估結果來瞭解製程的特定需求,應可引導過濾器的選擇。
最終無菌過濾: 液體製程流的消毒級過濾器包含額定孔徑為 0.2 µm 或更小,根據 ASTM F838 細菌截留標準進行驗證。此外,生物製造商必須執行過濾器驗證研究,以確認過濾器的滅菌等級性能以及在製程條件下與其液流的相容性。
透過生物負荷監測保持控制
監測有助於確定下游作業中的典型生物負荷水平,當超出臨界值時,可以啟動調查。
在生物負荷安全與取樣和測試之間取得平衡始終是一項挑戰,需要依賴風險分析來確定每個製程的適當策略。生物負荷偏移是製造過程中的真實風險 - 它們可能會破壞製造過程,而且成本高昂。有效的控制有賴於流程瞭解和全面的緩解計劃,以確保安全的藥物生產。
下載生物雜質和無菌控制電子書
我們的電子書 "任務控制:
我們的電子書 "Mission Control: Strategies for Effective Bioburden and Aseptic Control "專門針對生物負荷控制的各個層面而設計。
主題包括:
- 更詳細地瞭解下游處理過程中的生物負荷控制
- 如何根據您的生物負荷挑戰選擇過濾器
- 最大化殺菌級過濾效率的考慮因素
- 無菌過濾的產業趨勢
- 如何以品質設計方法將風險降至最低
填寫以下表格,即可將電子書直接傳送到您的收件匣。
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?