利用自組單層和 SAMDI-ToF 質譜法進行表面化學研究
Prof. Milan Mrksich
Department of Chemistry, The University of Chicago Chicago, IL
Material Matters Volume 3 Issue 3
現代合成化學允許建構精細的分子結構,對於藥品、催化劑和功能性聚合物的開發至關重要。化學家不再詢問是否能製備出目標結構,而是詢問如何有效率地製備出目標結構。當這些相同的反應應用在表面的製備時,卻有著截然不同的期望。雖然具有明確結構且可呈現廣泛官能基的表面很容易製備,但介面反應的產物難以定性,因此即使是最簡單的轉換也很難進行。具有諷刺意味的是,界面反應比相對應的均相反應更容易進行,因為反應過程只需要將反應混合物沖洗表面即可;然而,產品、產量和速率的表徵卻非常困難。對於在溶液中進行的反應,其產物很容易分離、純化,並使用 NMR、IR 及其他光譜方法進行表徵。當這些相同的反應在二維介面上進行時,由於存在少量的生成物,因此這些分析工具變得毫無用處,取而代之的是需要使用多種方法,這些方法雖然靈敏,但所提供的結構資訊卻很有限。1
本文描述了結合 sself-assembled monolayers with matrix-assisted laser dmass spectrometry--一種稱為 SAMDI MS 的技術,允許快速表徵界面反應所產生的產品。2 自組裝單層是一種極具吸引力的表面化學平台,因為在正常的實驗室環境下,將鍍金基底浸入端基取代的烷硫醇溶液中,就可以輕鬆地製備這種單層,而且它們在合成上也很靈活。後一種特性是由於組裝製程與帶有多種末端官能基的烷硫醇相容--因為硫醇對金的化學吸附是相當特殊的--而且所產生的單層具有熱穩定性,並與多種溶劑和試劑相容。3 商業供應商提供的烷硫醇試劑越來越多,而且不需要大量的儀器和設備,使得合成化學家可以使用這些基底。SAMDI MS 技術的發展終於提供了一種快速且常規的方法,來表征附著在自組裝單層上的分子反應,並可能促使分子表面化學的基礎與應用研究大幅成長。
最早利用雷射解吸質譜表征自組裝單層的例子來自 Hemminger、Fritsch、Wilkins 和 Hanley 的實驗室。4-6 例如,Fritsch 和 Wilkins 使用 308 奈米雷射解吸單層,並能觀察到烷硫酸鹽氧化所產生的烷磺酸鹽。在進行這項工作時,由於可用於雷射解吸質譜法的商用儀器有限,而且單層界面反應的例子仍然有限,因此無法更廣泛地採用這種方法。7 在典型的實驗中,將 SAMDI MS 中常用的基質分子溶液塗在單層上,並讓其乾燥。用氮激光輻照單層後,烷硫醇或類似的二硫化物會從金基板上有效地釋放出來,並顯示出這些分子的質量(圖 1)。在第一個例子中,我們用它來表徵五甲基環戊二烯與單層拴馬來酰亞胺基團的環加成反應、酰胺的形成以及叔丁酯的脫保護反應。在每種情況下,SAMDI 光譜都顯示出與反應前後的取代烷硫醇或其二硫化物相對應的峰值。SAMDI 可補足其他光譜技術的不足,因為它提供的是烷硫醇的總質量資訊,而非分子中存在的官能基的身分。此外,SAMDI 光譜的快速獲取(載入和分析樣品的時間少於十分鐘),使得此方法可用於評估反應產量和確認預期產品的存在。

圖 1.在稱為 SAMDI MS 的技術中,可使用基質輔助雷射解吸電離質譜法 (matrixassisted laser desorption-ionization mass spectrometry) 來表徵自組裝單層。使用氮激光來解吸單層,產生烷硫醇酯和相對應的二硫化物分子。質譜儀會報告這些分子的質量電荷比,並提供有關界面反應的產物、產量和速率的資訊。
自從這份早期報告以來,SAMDI 已經被廣泛應用,包括單層電化學反應所產生的產物的表徵、8 反應的組合發現、9 以及許多酵素介導轉換的例子。10-13 以下描述的三個範例展示了 SAMDI 在表徵自組裝單層界面反應所產生的產物方面所提供的獨特能力,進而使使用功能化表面的廣泛研究成為可能。
第一個範例針對的是呈現末端炔官能基的單層反應。基於氫原子與氚原子的氫基促進交換是一個簡單直接的反應,但在單層上進行表征時卻非常具有挑戰性。由炔基端和甲基端單層混合物製備的單層的 SAMDI 光譜顯示出對應於混合和對稱二硫化物的峰值。用氫化鈉處理單層,然後再用氧化氚處理,可以交換末端氫原子,二硫化物的質量分別增加了一個和兩個道爾頓(圖 2),證明了這一點。這個例子揭示了質譜法在表徵界面反應方面的直接應用,以及該方法固有的良好質量分辨率。此方法也被用來展示炔烃的水合作用以得到甲基酮,以及 Sonagashira 偶合作用以得到苯基乙炔。
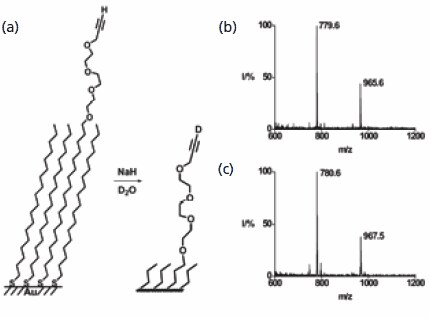
圖 2.SAMDI MS 用於表徵末端炔烴中氫與氚的交換。反應前的質譜顯示出 m/z 為 779.6 的峰值,反應後移至 780.6。相應的二硫化物顯示出預期的兩個道爾頓的質量增加。
第二個範例是開發多步驟合成序列,用以製作自組裝單層結構。單層常用於「生物晶片」應用中,在這種應用中,呈現肽類、碳水化合物或小分子陣列的表面可用來從大量可能的互動中找出酵素的底物或蛋白質的配體。14 在這些應用中,拴在單層上的分子通常會先使用既有的方法合成,然後再使用適當的結合化學物質固定在單層上。
肽和寡核苷酸陣列的早期工作利用了在基底上直接合成分子的方法,從而快速、高效地在表面上組裝成百上千個生物分子陣列。15 這些例子需要大量的努力來開發和優化陣列合成中使用的界面反應序列,其中最重大的挑戰是表徵界面反應的產品和產量。16
合成二糖陣列所使用的策略如圖 3 所示,首先是在三(乙二醇)端烷硫酸酯的背景下,以 5% 的密度顯示苯酚基團的單層。前者可作為吸附碳水化合物構成塊的親核體,後者可有效防止蛋白質的非特異吸附,因此對固定化糖類的後續生化檢測非常重要。17 單糖經過三乙酰化,第四個羥基被保護成乙酰丙酸酯,以便在接下來的步驟中進行選擇性的脫保護,製備成其三氯乙酰亞氨基,並用三氟甲磺酸三甲基硅酯活化,以偶合到苯酚基上。接著用肼處理單層以除去乙酰丙酸基,再用第二種單糖試劑處理,得到完全保護的二糖。使用甲醇鈉處理可去除乙酰基,得到固定化的二糖。SAMDI 光譜顯示每個步驟都以高產率進行,並得到預期的產品 (圖 3)。這個程序被用於製備二十四種不同的二糖--可以在六小時內完成--然後用於分析糖基转移酶的底物特異性。同樣地,使用質譜儀可以直接鑑定酵素反應的產物。
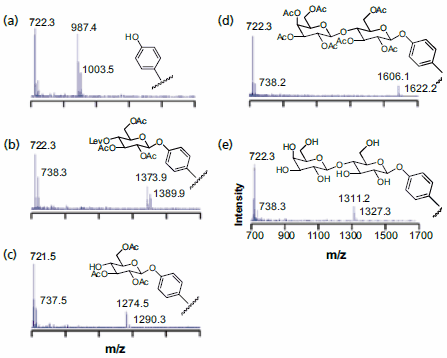
圖 3.SAMDI MS 用於表徵在單層基底上合成二糖的每個步驟之後的表面:(a) 呈現酚基的單層;(b) 偶合第一個碳水化合物;(c) 選擇性去除乙酰丙酸酯保護基;(d) 偶合第二個碳水化合物;(e) 最後脫保護。
第三個例子是關於 DNA 寡核苷酸的反應。DNA陣列包含數以萬計的不同序列,目前常用來分析細胞培養物中的基因表達模式,最近更被用來識別蛋白質與DNA的結合互動。18 這些陣列使用螢光標籤來偵測結合互動,因此不適用於化學反應性的研究,包括例如DNA與反應性小分子處理時所形成的共價加合物。19 為了附著 DNA,我們首先固定了生物素封端的烷硫醇,然後結合鏈霉親和素蛋白質,使表面可用來捕捉生物素標記的寡核苷酸雙工體。我們用抗癌藥物順式鉑處理了一組二重體,並使用 SAMDI 鑑定反應中形成的單加合物和雙加合物(圖 4)。SAMDI 方法的靈活性,加上製備和應用 DNA 陣列的成熟方法,可能會大幅擴展陣列的應用範圍。
![Chemistry at Surfaces with Self-Assembled Monolayers and SAMDI-ToF Mass Spectrometry 生物素化的雙工 DNA (5'-biotin-TTT TAT ATA CGT ATA TCG) 與順式-[Pt(NH2)2Cl2]反應。](/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/articles/materials-science-and-engineering/polymer-synthesis/biotinylated-duplex.gif)
圖 4.SAMDI MS 用於表徵生物素化雙工 DNA (5'-biotin-TTT TAT ATA CGT ATA TCG) 與順式-[Pt(NH2)2Cl2] 反應所產生的產品。分別顯示反應時間為 0、4 及 21 小時 (A, B 及 C) 的光譜。
本綜述中總結的例子說明了 SAMDI 在快速評估自組裝單層界面反應的產物和產率方面的價值。目前還沒有任何方法或其組合可以提供附著在表面上的分子結構的全面資訊,就像 NMR 和 X 射線衍射技術對於大量製備的分子所提供的資訊一樣。目前,表面化學研究使用多種方法來組合對界面結構的了解 (通常並不完整),包括使用紅外線光譜來識別官能基團、使用 X 射線光電子光譜來確定元素組成,以及使用橢圓儀測量單層厚度。透過提供烷硫醇的分子量,SAMDI 可補足這些方法,並提供其他方法無法提供的分子資訊。最重要的是,此方法簡單易用,可為合成化學家提供可用於開發和實現單層上各種化學作用的資訊。這些優點應該可以開發出具有複雜結構的表面,用於廣泛學科的基礎和應用研究。
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?