根據 FDA 方法 C-010.02 使用 QuEChERS 進行鮭魚中 16 種 PFAS 的 LC-MS/MS 分析
全氟和多氟烷基物質 (PFAS),又稱永續化學品,是過去數十年來因其多用途的物理和化學特性(如撥水、消防泡沫、炊具、食品包裝)而廣泛應用於商業產品應用的一類化合物。由於其化學穩定性,PFAS 化學物質普遍存在於我們的環境中,長期使用會對人體造成生物累積的潛在風險。為了限制對人類健康可能造成的風險,例如嬰兒出生時體重過低、癌症和對免疫系統的影響,EPA 和 FDA 等監管機構已針對特定的 PFAS 物質制定了包含限值和 PFAS 分析方法的 PFAS 法規。1-4 美國食品及藥物管理局 (FDA) 已制定 PFAS 法規,包括特定 PFAS 物質的限值和 PFAS 分析方法。食品藥物管理局 (FDA) 發布了從食品樣品中提取 PFAS 的建議,應用經修訂的 QuEChERS(快速、簡便、廉價、有效、堅固和安全)方法萃取和淨化步驟(使用分散固相萃取 - dSPE),並使用弱負離子交換 (WAX) SPE 柱對獲得的 QuEChERS 萃取物進行附加淨化,然後進行 LC-MS/MS 分析。4 對於 FDA 方法 C-010.024,萃取鹽混合物包含 6.0 g MgSO4 以及 1.5 g NaCl,以及含有 900 mg MgSO4、300 mg 伯仲胺 (PSA) 和 150 mg 石墨化炭黑的 dSPE 清理混合物。Supel™ QuE 非緩衝型萃取鹽混合物 (55295-U) 和新開發的 用於清理的Supel™ QuE PSA/ENVI-Carb™管3 (55479-U) 符合這些方法的要求。本研究中的進一步清理,Supelclean™ ENVI-WAX™ SPE 試劑盒直接等同於 FDA 方法 C-010.02 中指定的 SPE 試劑盒。本應用筆記概述根據 FDA 方法 C-010.02 開發的其中一種 PFAS 檢測方法,使用 LC-MS/MS 分析鮭魚中的 16 種 PFAS 化合物。
部分概述
Experimental- PFAS Analysis Method
PFAS標準品及溶液的製備
原生及同位素標示的PFAS標準品以甲醇50 µg/mL儲備溶液取得。然後按照方法 C-010.02 的稀釋方案將這些標準液用甲醇稀釋,以獲得所需濃度範圍內的校準標準液(外部校準:0.01、0.05、0.10、0.50、1.0、5.0、10 和 25 ng/mL)。
樣品製備
按照美國 FDA 方法 C-010.02 的要求,對三文魚樣品進行 PFAS 分析。三文魚樣本(5 g,用刀磨均質化)添加了 0.05、0.5 或 2.0 ng/g 的 16 種原生 PFAS,並進一步添加了 2 ng/g 的 8 種同位素標記內標。加入 5 mL 水、150 µL 甲酸和 10 mL 乙腈後,劇烈振盪樣本以萃取 PFAS。為了測試潛在的 PFAS 背景污染,鮭魚樣品只添加同位素標示的內標,並進行同樣的處理。在加入 Supel™ QuE 盐包(6.0 g MgSO4、1.5 g NaCl, 55295-U),將混合物放在搖床上以 1500 rpm 搖晃 10 分鐘,然後以 4000 g 離心 10 分鐘。將所獲得的上清液轉入第二支試管,即 Supel™ QuE PSA/ ENVI-Carb™ Tube 3(含 900 mg MgSO4、300 mg PSA、150 mg ENVI-Carb,55479-U),以 1500 rpm 搖動 10 分鐘,然後以 4000 g 離心 10 分鐘。隨後,使用 Millex® 尼龍 0.2 µm 注射器過濾器 (SLGNX13) 過濾上清液。對於三文魚樣品,在依照上述 FDA 方法進行 LC-MS/MS 分析前,需進一步進行 SPE 淨化。因此,將 1 mL 過濾上清液移入試管,用水稀釋至 15 mL。使用 Supelclean™ ENVI-WAX™ SPE 試劑盒 (500 mg, 6 mL, 54057-U)進行 SPE 淨化,以 9 mL 0.3% NH4OH in MeOH 并用 5 mL 水平衡。三文魚樣品 (15 mL) 載入並通過濾筒後,加入 5 mL 水作為清洗步驟。在用 4 mL 0.3% NH4OH in MeOH 洗離分析物之前,先將濾盒乾燥 1 分鐘,再用 4 mL 0.3% NH4OH in MeOH 洗離分析物至另一管中。最後,樣品蒸發至乾,在 1 mL MeOH 中重製,並在 LC-MS/MS 分析前加入 5 µL 內標 N-EtFOSAA-d5 (200 ng/ml)。
LC-MS/MS分析
使用Agilent 1290 Infinity II儀器耦合Agilent 6495C三重四極杆質譜儀進行LC-MS/MS分析。分析物的分離使用 Purospher® Star RP-18 endcapped (2 µm) Hibar HR(15 cm x 2.1 mm, 1.50649)作為分析柱。此外,延遲柱 (Purospher® Star RP18 endcapped Hibar RT (5 cm x 4.0 mm, 3 µm, 1.50428)位於混合閥之後、自動取樣器之前,以抵銷來自 LC 系統的潛在 PFAS 污染 (例如、泵、管子、配件、過濾器)可能產生的 PFAS 污染。我們選擇了 Purospher® STAR HPLC 色譜柱,因為即使在較高的 pH 值下,例如在有基本流動相添加劑(如 C-010.02 方法中建議使用的 1-甲基哌啶)的情況下,這些色譜柱通常也能提供穩定的 HPLC 分離效果。我們測試了在流動相中添加或不添加 1-甲基哌啶的方法。由於在所提出的應用中使用該添加劑並沒有獲得顯著的靈敏度增益,因此我們在不使用 1-甲基哌啶的情況下進行了分離,但為此應用保留了色譜柱,以便也為基本 MP 條件進行準備。為了避免玻璃表面可能吸附 PFAS,使用聚丙烯扣蓋瓶代替標準玻璃瓶。LC 和 MS 條件列於表 1。
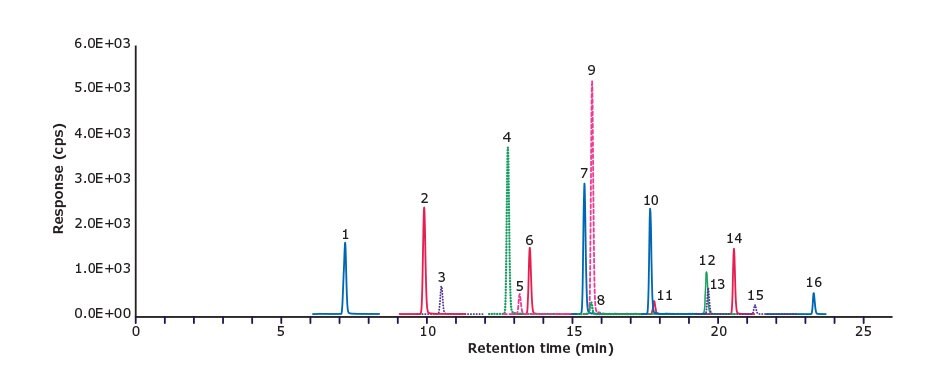
圖 1.16 種 PFAS 化合物在甲醇中的濃度為 1 ng/mL(峰 ID 見 表 2)。
根據FDA的食品、飼料、化妝品和獸藥產品化學方法驗證指南,對於濃度在0.001 mg/kg (1 ng/g)。表 3 顯示實驗研究中的回收率和 RSD %,其中 16 種化合物一式三份分別以 0.05、0.5 和 2.0 ng/g 的濃度水平添加到三文魚樣本中。在使用過的鮭魚中進行 PFAS 背景評估 (鮭魚樣品只添加同位素標示的內標),發現有 3 種 PFAS 分析物的濃度超過 LLOQ (PFBA 與 PFOS 為 0.02 ng/g,PFOA 為 0.04 ng/g)。為了精確計算PFBA、PFOS和PFOA在最低添加水平(0.05 ng/g)下的分析物回收率,相應地減去了在鮭魚中發現的背景水平。所有得到的回收率和%RSD都在建議的範圍內,因此符合FDA方法的要求。5
結論
在本應用筆記中,研究了基於 QuEChERS 方法分析鮭魚樣品中 16 種 PFAS 的 FDA 方法 C-010.02 的工作流程。在 0.05 ng/g、0.5 ng/g 和 2.0 ng/g 的強化水平下,所有 16 種化合物的回收率均在 FDA 相關方法驗證指引中規定的可接受範圍內。計算出的 RSD 低於 22%,進一步表明其精密度令人滿意。因此,採用新的 Supel™ QuE PSA/ENVI-Carb™ Tube 3 清除混合液 (55479-U),加上 Supel™ QuE 萃取鹽混合液、Supelclean™ ENVI-WAX™ SPE 濾筒和 Millex 針筒過濾器,在 PFAS 測試方法中都顯示出適用的樣品製備產品的功效,可達到所需的食品樣品淨化效果。本方法中使用了 Purospher® STAR RP-18 HPLC 色譜柱,因為這些色譜柱通常可在較寬的流動相 pH 值範圍內提供穩定的分離效果,例如在有基本流動相添加劑(如 C-010.02 方法中所述的 1-甲基哌啶)的情況下。
PFAS 分析標準
樣品製備、HPLC 及配件
請同時參閱我們專用的 2.7 µm Fused-Core® 粒子 Ascentis® Express 90 ÅPFAS 和 Ascentis® Express 90 Å PFAS Delay 列。
更多有關 PFAS 測試的資訊,請參閱 SigmaAldrich.com/pfas
。參考文獻
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?