簡介

在過去的幾年中,Knochel 及其同事報告了用於選擇性金屬化、去質子化和親核加成的試劑。這些試劑改變了這個領域,讓含有敏感官能性的分子在溫和反應下,前所未有地選擇性轉化成反應性中間體。
Network error: Failed to fetch
使用 i-PrMgCl-LiCl和 s-BuMgCl-LiCl的選擇性金屬化反應
儘管鹵金屬交換反應是製備有機金屬試劑最常見的方法之一,但利用鋰鹵素交換反應的限制包括與分子中其他官能性的相容性以及對低溫的要求。另一方面,鎂鹵素交換反應需要較高的溫度,這也會因與分子中的官能性相容而影響其效用。此外,由於有機鎂試劑的反應性較低,因此可能會發生競爭反應,例如烷基鹵化物中的 HX 會被消除而產生烯烴。Knochel 及其同事發現,使用鹽添加劑可以提高反應速率和效率。經過一番優化後,發現最有效的試劑是用 R-MgCl (R = i-Pr (656984), s-Butyl (703486)) 和 1.0 equiv of LiCl.1 使用這些試劑,可以將多種官能化和高靈敏度的底物轉換為相應的官能化有機金屬試劑,包括芳基和雜芳基鎂衍生物。反應性的增加可能是由於已知存在於典型格氏試劑中的聚合物聚合體破裂,以及由於所形成物種中的鎂帶有負電荷而增加了反應性&。nbsp;i-PrMgCl2-LiCl+ (增加了 i-pr 基的親核性)。鹽的速率增強和促進作用使這些高效試劑被稱為 TurboGrignards。這項技術的一些優點如下:
優點
- 增加了官能基的相容性
- 反應條件溫和,包括方便的溫度範圍
- 抑制了副反應
- 允許製備官能化的雜芳基有機金屬
- 可大規模生產 Grignard 試劑
代表性應用
Knochel 及其同事研究了各種芳基底物(表 1),包括那些含有敏感官能性的底物,包括 CO2R、CN、OMe 和鹵素。在所有情況下,底物都能耐受 TurboGrignard 試劑,容易形成有機金屬,並能有效地與大量親電體反應。雖然 TurboGrignards 的反應速率有所提升,但這種反應性的提升並未對反應的整體範圍造成負面影響,允許在各種官能基的存在下進行轉換。甚至雜芳基鹵化物也能在 i-PrMgCl-LiCl的存在下,以極佳的產率轉換成對應的有機金屬化合物(表 2)。
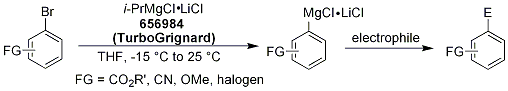
方案 1.用於選擇性金屬化的 i-PrMgCl-LiCl (TurboGrignard)

表 1.使用 i-PrMgCl-LiCl 製備芳基格氏化合物並與各種親電體進行後續反應

表 2.使用 i-PrMgCl-LiCl 製備的異芳基格氏化合物及其後與各種親電體的反應
在過去幾年中,Knochel 及其同事已證明 TurboGrignards 的實用性。以下是利用 TurboGrignard 製備的 Grignard 的幾個關鍵轉換的摘要, i-PrMgCl-LiCl.2
。| 應用程式 | 範例 |  | Ren, H.; Krasovskiy, A.; Knochel, P. Org.Lett. 2004, 6.4215. |
|---|---|---|---|
| 2005 | Org.img height="218" alt="" width="252" src="/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/articles/chemistry-and-synthesis/reaction-design-and-optimization/table-3-2.gif" /> | Ren, H.; Krasovskiy, A.; Knochel, P. Chem.2005, 543. | |
| 2005 |  | Liu, C-Y.; Knochel, P. Org.Lett. 2005, 7, 2543. | |
| 2006 | Org.img height="119" alt="" width="328" src="/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/articles/chemistry-and-synthesis/reaction-design-and-optimization/table-3-4.gif" /> | Ren, H.; Knochel, P. Chem.2006, 726. | |
| 2006 | Chem.img height="105" alt="" width="258" src="/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/articles/chemistry-and-synthesis/reaction-design-and-optimization/table-3-5.gif" /> | Sinha, P.; Knochel, P. SynLett 2006, 19, 3304. | |
| 2006 | Preparation of Grignards reagents in the presence of masked ketones and aldehydes (using readily deprotectable silylated cyanohydrins) |  | Liu, C.-.Y.; Ren, H.; Knochel, P. Org.2006, 8, 617. |
| 2006 | Preparation of Benzylic Grignards via Sulfur-Magnesium exchange | Org Lett.img height="165" alt="" width="298" src="/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/articles/chemistry-and-synthesis/reaction-design-and-optimization/table-3-7.gif" /> | Stoll.A, H.; Krasovskiy, A.; Knochel, P. Angew.Chem.Int.Ed. 2006, 45, 606. |
| 2007 | Functionalization via I-Mg Exchange of unprotected aromatic and heteroaromatic carboxylic acids |  | Kopp, F.; Knochel, P. SynLett 2007, 980. |
| 2007 | SynLett 2007, 980.img height="177" alt="" width="258" src="/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/articles/chemistry-and-synthesis/reaction-design-and-optimization/table-3-9.gif" /> | Kopp, F.; Wunderlich, S.; Knochel, P. Chem.Comm. 2007, 2075. | |
| 2007 | Pyridyne formation |  | Lin, W.; Chen, L.; Knochel, P. Tetrahedron 2007, 63, 2787. |
| 2008 | Tetrahedron 2007, 63, 2787.img height="71" alt="" width="232" src="/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/articles/chemistry-and-synthesis/reaction-design-and-optimization/table-3-11.gif" /> | Despotopoulou, C.; Bauer, R.C.; Krasovskiy, A.; Mayer, P.; Stryker, J. M.; Knochel, P. Chem.Eur.J. 2008, 14, 2499. | |
| 2009 | Preparation of 2,3-functionalized furans, benzofurans, and thiophenes |  | Melzig, L.; Rauhut, C. B.; Knochel, P. Chem.Commun. 2009, 3536. |
| 2009 | Chem.img height="77" alt="" width="346" src="/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/articles/chemistry-and-synthesis/reaction-design-and-optimization/table-3-13.gif" /> | Rauhut,C. B.;Cervino,C.;Krasovskiy,A.;Knochel,P.SynLett 2009, 67. |
Selective Deprotonations using Knochel-Hauser-Base
芳香族的去質子化和官能化是一種關鍵的合成轉換。然而,常見的強有機鹽基如烷基鉍或鋰酰胺會引起競爭性的加成反應 (Chichibabin 反應)。此外,由於許多酰胺在溶液中的穩定性較低,因此必須在原位生成。最後,使用這些鹽基時所需的低溫會造成使用上的不便。Knochel 及其同事報導了使用 TMPMgCl-LiCl 來進行鹵素和雜鹵素的區域選擇性去質子化。3 在加入親電體進一步闡釋後,可以優良的收率選擇性地獲得官能化的鹵素和雜鹵素。這種鹽基被稱為 Knochel-Hauser-鹽基,這項技術的一些優點如下:
優點
- 高官能基耐受性
- 由於 LiCl 的存在而具有高動力學活性 增加基本性
- 在 THF 中的可溶性
- 無 Chichibabin 反應,一般副反應較少 炔和雜炔的區域選擇性金屬化
代表性應用
我們發現豪澤鹽基 TMPMgCl-LiCl 在許多情況下都很有效,既擴大了反應範圍,又能容納多種官能基。對於鹵素和雜多烯的區域選擇性金屬化不僅有效,而且優先於不希望發生的副反應,在存在敏感官能性的情況下,溶解度也有所提高。作者認為低聚物在 TMPMgCl-LiCl 的存在下會被分解。下表包含許多經檢驗後發現適合使用 TMPMgCl-LiCl (703540)(表 4)進行官能化的底物。

方案 2.TMPMgCl-LiCl 用於選擇性反質子反應

表 4.使用 TMPMgCl-LiCl 製備異芳基格氏劑,並與各種親電體進行後續反應
還證明了其他區域選擇性金屬化作用。Mg/Li 混合酰胺成功地金屬了 2-苯基吡啶中的苯基環,而不是通常優先的 2-吡啶位置(方案 3)。即使是歷史上具有挑戰性的嘧啶金屬化也證明是成功的,提供了金屬化的中間物 Grignard,用 I2 將其碘化(方案 4)。嘧啶的區域選擇性金屬化最好是在逆加成條件下進行,即嘧啶加到 TMPMgCl-LiCl 的溶液中。Knochel-Hauser-Base TMPMgCl-LiCl 對於含有對碱敏感官能性的芳基和雜芳基化合物的去質子化也很有效 (Scheme 5).
。
方案 3.2-Phenyl Pyridine 與 TMPMgCl-LiCl 的金屬化及其後的官能化

方案 4.5-Bromo-Pyrimidine 與 TMPMgCl-LiCl 的金屬化及其後的官能化

方案 5.TMPMgCl-LiCl 與含有鹼敏感官能性的芳基和異芳基底物的反應及後續官能化
使用 TMPMgCl-LiCl 金屬化炔類衍生物的範圍也經過研究,發現其範圍非常廣泛。如下所示,使用 TMPMgCl-LiCl 製備了多種官能化芳基格氏化合物,之後再使用各種親電體進行誘捕。

表 5.使用 TMPMgCl-LiCl 製備芳基格氏化合物,並與各種親電體進行後續反應
Knochel 及其同事還報導了使用 TMPMgCl-LiCl 進行噻吩全官能化合成的方法。2,5-二氯噻吩與 TMPMgCl-LiCl 的反應提供了 3-金屬化的噻吩。接著與多種親電體進行捕集,然後與 TMPMgCl-LiCl 進行反應。這提供了 4 取代的鎂化物,再透過與第二個親電體反應進一步製成。噻吩上的氯化物可以還原,或還原後與 TMPMgCl-LiCl 發生鎂化反應,然後用親電體淬滅,或通過插入鎂進一步官能化,然後用 ZnCl2 進行交叉耦合。5 方案 7 重點介紹了通過與 TMPMgCl-LiCl 金屬化的迭代方法來獲得完全官能化的噻吩。作者接著以 36% 的總產率製備了吡咯的噻吩衍生物 Atorvastatin (Lipitor)。

方案 6.取代噻吩的製備

方案 7.全官能化噻吩的製備
使用 LaCl3-2LiCl 進行選擇性 1,2 加成
在酮的親核加成中,镧系元素鹽類已被證明可以防止競爭性還原和烯化副反應。然而,镧系配合物的溶解度以及乾燥方法的性質,在歷史上都限制了其使用範圍。LiCl 的加入使幾種有機金屬試劑的反應性增強;因此,Knochel 及其同事製備了 LaCl3-2LiCl,並發現它可溶解於 THF 中。因此,在 LaCl3-2LiCl 的存在下,即使是固態受阻或可烯化的酮和邁克爾受體,以及未活化的亞胺,都可以乾淨地進行 1,2 加成,以提供所需的產品,從而大大改善反應範圍。此外,催化劑的其他優點還包括6:
優點
- 含水量低
- 無需進行預處理
- 易於處理
- 產生均勻的反應混合物
- 方便的反應條件
催化劑的其他優點
代表性應用
如下所示,在親氧的 LaCl3-2LiCl 存在下,將格氏試劑加入到酮中可促進選擇性的 1,2-加成(方案 8)。

方案 8.LaCl3-2LiCl 介導的 1,2-加成反應

表 6.LaCl3-2LiCl 介導的酮加成反應
繼首次發表使用可溶且高效的镧鹽-LiCl 複合物之後,Knochel 及其同事報告稱亞幾何量的镧鹽足以促進所需的 1,2- 加成。此方案適用於烷基、芳基和雜芳基格氏試劑。7
在 LaCl3-2LiCl 的存在下,也進行了環戊酮與 n-BuLi 的加成,並僅提供了 1,2- 加成產物 (98%)。此外,催化量的 LaCl3-2LiCl 允許 Grignard 試劑加到未活化的亞胺中,提供了收率極佳的胺產品。在沒有使用镧系鹽的情況下進行的類似反應,提供的胺產品收率很低。
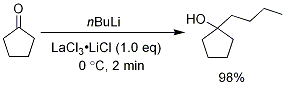
方案 9.1,2-在 LaCl3-2LiCl 的存在下加入 n-BuLi

方案 10.在 LaCl3-2LiCl 的存在下,有機鎂試劑與非活化胺的親核加成作用
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?為便利客戶閱讀,此頁面中文以機器翻譯完成。雖然我們已盡力確保機器翻譯的準確性,但機器翻譯並非完美。如果您對機器翻譯的內容不滿意,請參考英文版本。