使用 CellASIC® ONIX2 微流控平台對淋巴細胞和癌細胞中 Caspase 介導的細胞凋亡和細胞缺氧進行動態活細胞成像
Cindy Chen, PhD., Jun Park, Ph.D., Nick Asbrock
活細胞成像 是測量癌症特徵(如凋亡和缺氧)的理想方法。眾所周知,癌細胞具有逃避細胞凋亡的能力,而細胞凋亡是細胞在外界刺激下啟動自身死亡的機制。缺氧是一種以低氧為特徵的環境,也是實體腫瘤的另一種常見特徵。缺氧的癌細胞通常對細胞凋亡和化療更具抵抗力,使癌細胞得以轉移,並形成侵襲性的惡性表型。缺乏營養的低氧微環境會使細胞無法進行能量依賴性凋亡,細胞會變得壞死。低氧誘導因子 1 (HIF-1),可透過誘導高濃度的促凋亡蛋白 (如 BNIP3) 來啟動細胞凋亡,並可造成 p53 的穩定。Caspases 是蛋白酶家族的一種,在程式化細胞死亡和發炎中扮演重要角色。嚴重缺氧可以誘發 caspase-9 和 caspase-3 活化,從而導致細胞凋亡。
傳統的檢測方法可以測量 apoptosis (Annexin-V, Caspase and TUNEL assays) and 缺氧 (HIF1α 表達和 Hypoxyprobe/EF5)是需要細胞固定或裂解的終點檢測,無法捕捉即時反應。捕捉活細胞凋亡和缺氧事件允許在生理條件下進行單細胞分析和即時單細胞追蹤,從而產生更多相關資料。在此,我們利用 BioTracker 活細胞染料針對 caspase-3 和缺氧,在 CellASIC® ONIX2 微流控系統上量測活細胞的凋亡和缺氧。
圖 1.BioTracker 活細胞螢光凋亡和缺氧染料的作用機制。BioTracker NucView® 488 綠色 caspase-3 染料由含氟 DNA 染料與 caspase-3/7 DEVD 識別序列耦合而成。染料最初是不發光的,會穿透質膜進入細胞質。在凋亡細胞中,caspase-3/7 會裂解底物,釋放出高親和性的 DNA 染料,染料會移動到細胞核,使 DNA 染上鮮綠的螢光。在缺氧條件下,BioTracker 520 綠色缺氧染料中的偶氮基會發生還原性裂解,產生 2Me RG,發出亮綠色螢光。較低的氧含量(更嚴重的缺氧條件)會導致更大的螢光強度。
方法與結果
活細胞成像影片
細胞凋亡
。缺氧
。活細胞凋亡成像實驗
首先將Jurkat細胞(88042803)載入CellASIC ONIX M04T Pad Trap Plate (M04T-01-5PK),然後用BioTracker NucView® 488 Green Caspase-3 Dye (SCT101)在完全RPMI-1640培養基(SLM-240-B)中孵育30分鐘,然後用2.5 µg/mL CD-95 抗體 (05-201) (實驗組) 或不處理 (對照組) 12 小時。使用 FITC 濾光片在 400 倍放大鏡下,以 30 分鐘的間隔對細胞進行延時成像。
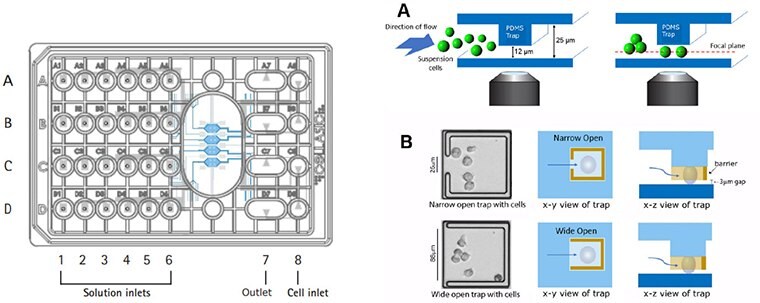
圖 2. Cellasic® ONIX M04T 墊式陷阱板設計。Trap 板採用 4 室細胞培養板,專為在活細胞成像實驗中將細胞保持在單一焦點平面內而設計。此板可透過精確的環境控制,以單細胞解析度對 12 µm 大小的懸浮細胞進行即時成像。

圖 3.caspase 介導的活免疫細胞凋亡時間過程。在活細胞中,CD-95 抗體孵育後 3 小時左右,凋亡的 jurkat 細胞開始發出 caspase 介導的綠色螢光。使用 CD-95 抗體孵育 12 小時後,100% 的細胞會發出綠色螢光,細胞凋亡。
首先將Jurkat細胞(88042803)載入CellASIC ONIX M04T Pad Trap Plate (M04T-01-5PK),然後在完全RPMI-1640培養基(SLM-240-B)中用BioTracker NucView® 488綠色Caspase-3染料(SCT101)和Annexin V Texas Red(紅色)孵育前2小時,然後處理2.5 µg/mL CD-95 抗體 (05-201) (實驗組)或不處理(對照組)8 小時。使用 FITC 和 Texas-Red 濾光片,在 400 倍放大鏡下,以 10 分鐘的間隔對細胞進行延時成像。

圖 4.活體免疫細胞多重凋亡事件的時間過程。凋亡的 jurkat 細胞在 CD-95 抗體孵育後 3 小時左右開始發出由 caspase 介導的綠色螢光,然後在 8 小時時發出由 Annexin V 介導的紅色螢光。雙標記的細胞呈現黃色。
活細胞缺氧成像實驗
A431表皮癌細胞(85090402)在37 °C的常氧條件(20% O<% O<%)下,以重力灌注法將3μM BioTracker 520 Green Hypoxia Dye (SCT033)在完全 DMEM (SLM-241-B) 中孵育 16 小時,使用 CellASIC® ONIX2 System (M04S-03-5PK),在常氧條件下 (20% O2) )37 °C重力灌注。培養過夜後,在低氧條件(0% O2)下,以 1psi 的壓力灌注不含染料的完整培養基,在 37 °C 下持續 16 小時。在低氧條件(0% O2)下培養 16 小時後,在相同的影像設定下,使用 FITC 頻道拍攝經染色處理和未經染色處理的細胞影像。對於時間過程實驗,在 16 小時的時間內每 3 小時擷取一次螢光影像。

圖 5.CellASIC® ONIX 用於哺乳類動物細胞設計的切換板。M04 切換板可連續灌注培養進行活細胞分析。層流提供快速且均勻的溶液交換,以達到最大的細胞健康。玻璃蓋玻片底面可確保最高解析度的光學觀察。

圖 6.活體癌細胞缺氧的染料特異性。低氧暴露 16 小時後,BioTracker 520 Green Hypoxia Dye 的螢光強度增加,可識別低氧細胞。

圖 7.活體癌細胞缺氧的時間過程。在 9 小時的時間內,BioTracker 520 綠色缺氧染料的螢光強度會隨著氧含量的降低(缺氧條件增加)而增加。
結論
程式化細胞死亡/凋亡和缺氧在許多生物系統的發展和平衡過程中扮演著重要的角色。儘管許多研究都依賴生化或分子方法來進行研究,但由於懸浮細胞的非黏附性,其凋亡和缺氧過程的活細胞成像 提出了獨特的挑戰。在此,我們利用 CellASIC ONIX 微流控系統,在單細胞層級對 CD95 (Fas,Apo1) 介導的 Jurkat Tcells 和缺氧的 A431 癌細胞的凋亡過程進行動態活細胞成像。我們使用 Caspase-3 特異性 DNA 結合探針 (SCT101) 和細胞壁酸還原酵素介導的缺氧染料 (SCT033),分別以多重方式觀察細胞凋亡的開始、核形態、磷脂酰絲氨酸 (PS) 轉移和缺氧。我們成功地在單細胞層級監測到 CD95 誘導的 T 細胞凋亡和缺氧的時間群動態,清楚地劃分出這兩種凋亡事件之間的動力學,以及對 CD95 反應的異质性。該技術可透過按需擾動,監測細胞對不同試劑的反應,從而更深入地瞭解細胞凋亡和缺氧的機制,同時也適用於以活細胞圖像為基礎的廣泛細胞生物學研究。
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?