什麼是玻尿酸?
透明質酸(HA)是最簡單的糖胺聚糖(帶負電的多醣類),也是 細胞外基質 (ECM)。1 透明質酸是細胞分泌的一種支架,在體內包圍著細胞 2 HA 是一種線性、非硫酸化的多醣體,可在 ECM 內提供壓縮強度、潤滑和水合作用。sup>2 它還能調節細胞黏附性和運動性3,4 並介導細胞增殖和分化5 使其不僅成為組織的結構成分,還是一種活躍的信號分子。
發現更多關於半合成透明質酸基三維水凝膠的三維細胞培養應用 使用 HyStem™ 平台。
命名法
- 透明質酸(Hyaluronan,指玻尿酸)是一種透明質酸。透明質酸(指所有生理形式的HA,其中最常見的是鈉鹽)
- 透明質酸
化學與物理性質>透明質酸的化學和物理性質
透明質酸是一種由兩種單糖組成的線性、不分枝的交替聚合物:ß(1,4)-N-acetyl-D-glucosamine 和 ß(1,3)-D-glucuronic acid(見圖)。6 它是非硫酸化的,不像其他Glycosaminoglycans (GAGs) 在 ECM 中顯著,例如肝素和硫酸軟骨素。HA 的鏈長從 ~0.200 到 10 MDa 不等,最常見的大小為 2-5 MDa。
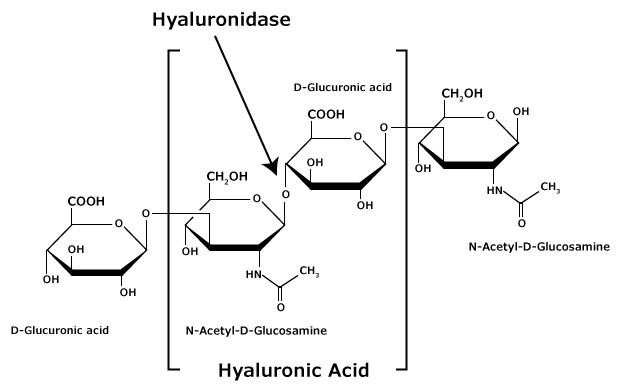
圖 1.透明質酸是由β-D-(1-3)葡萄糖醛酸和β-D-(1-4)-N-乙酰葡萄糖胺的交替殘基所組成。
HA溶解在水中形成粘彈性溶液,隨著濃度增加,溶液粘度升高(10 mg/ml的粘度是水的5000倍),6 然而,在剪切應力作用下,粘度迅速下降,同時保持彈性。9 HA 在 ECM 中的實際結構不盡相同,但其一般特徵為具有延伸構象和相當大的內在硬度的隨機線圈。相鄰糖類之間的氫鍵似乎是設定 HA 生理特性的最重要力量,9 然而,HA 體外 的物理特性也受到離子強度的顯著影響。
在我們的 Glycobiology hub page上尋找更多技術資源。
| 位置 | HA的數量 | 。半衰期 | MW範圍 |
|---|---|---|---|
| 細胞外基質 | >2。5 g/L | 小時至數週 | 高 |
| 非膜臍帶 | 2-4 g/L | - | - |
| 合成液(真皮) | 2-4克/升 | 小時 | 高 |
| 胸腔淋巴 | <10 mg/L | 分鐘 | 分散 |
| 血清 | 0。01-0.10 mg/L | 分 | 低 |
| 總體 | 15克/70公斤 | - | - |
結構2,6
HA 與 ECM 中的其他 GAG 一起提供組織的抗壓強度。它的負電荷、親水性和長聚合物長度使大量的水與基質結合。此外,HA 在剪切應力時可降低黏度的獨特特性意味著它可作為潤滑劑。在靜態條件下,它可提供彈性。最後,除了提供細胞周圍的水合空間外,它還能因其孔隙大小和電荷密度而調節生長因子和其他訊號的流量。
信號傳輸
HA有六個特性化的細胞表面受體:12,13
- CD44
- RHAMM (透明質酸介導的動力受體)、CD168
- LYVE-1 (淋巴管內皮 HA 受體-1)
- HARE (透明質酸介導的動力受體)、CD168
- LYVE-1 (淋巴管內皮 HA 受體-1)/li>
- HARE(內吞透明質酸受體)
- layilin
- Toll-4
- CD44和RHAMM是目前特徵最好的。11-13
CD44
CD44 是一種 I 型單通、跨膜蛋白質。11,13 CD44中能競爭性結合較長HA聚合物的最小HA單位是十糖。7 CD44在許多細胞類型中大量表達。它有 17個同工型。由於各種不同的翻譯後修飾(糖基化、磷酸化和蛋白質軟酯酰化),CD44 更具有異质性。CD44 已被證實具有大量的細胞功能,包括作為:13
- HA受體
- 中間膜蛋白多糖
RHAMM(透明質酸介導的動力受體)不是跨膜蛋白。相反,它與細胞表面結合,但存在於多個細胞間隔中。RHAMM 也會與硫酸化的 GAGs 結合,例如肝素。到目前為止,這種 HA 結合蛋白已被證實參與以下活動:
- PDGF和HA介導的SRC、FAK、PKC和ERK信號傳導級串的活化
- 對創傷反應的移動性
- 通過細胞週期G2M的進程
- 血管生成過程中的管小管形成
發育/胚胎發育
"儘管在大多數組織發育的描述中基本上都忽略了這一點,但最重要的細胞行為之一允許形成第一個特化的組織形式(即:纖維)。e.,13
ECM不僅在組織的平衡中扮演重要角色,在組織的發育中也扮演重要角色。當新的上皮形成時,基底膜也會同時形成。這包括在胚胎的外胚層和內胚層生成上皮時。在胚胎發育過程中,層黏蛋白是基底膜最先排出的 ECM 蛋白質。在 8 細胞期的胚胎中,可以觀察到它以點狀模式出現在細胞間的空隙中。在發育的後期,纖維連結素、硫酸肝素和膠原蛋白 IV 會在相同的區域累積。膠原蛋白 IV 的沉積和自我組合會導致基底膜的組織,進而組織附著的細胞,導致上皮單層的極化。13
胚胎ECM擁有大量的糖胺聚糖(GAGs),其中以HA為主。14 人類胚胎幹細胞(H1、H9和H13品系)已證實同時表達CD44和CD168(RHAMM),它們都是HA受體。人類胚胎幹細胞(hESCs)也是透過包覆在HA水凝膠中來培養的。這些細胞經過 15 天的培殖後,並未出現可察覺的分化。14
HA大量存在於胚胎肝臟、胎兒肝臟和肝臟內幹細胞龕(Canals of Hering)的ECM中。將肝幹細胞和祖細胞(肝母細胞)包裹在HA水凝膠中,並使用完全定義的培養基(久保田培養基)培養,已成功培養了4周以上而沒有分化。15
癌症
HA在癌症中所扮演的角色仍有待闡明。到目前為止,已有十四種癌症被證實在腫瘤細胞或周圍的基質中有透明質酸含量升高的現象,16,19 然而,這是否是一種因果關係還不清楚。對於卵巢癌而言,HA 的累積與癌症之間的相關性非常強,因此被認為是預後的指標。19 低MW HA可以刺激腫瘤細胞的移動(高MW HA則不能),19 ;最近,抑制內源HA合成(透過轉染反義-HAS,透明質酸合成酶)已被證明,當皮下注射到免疫功能低下的小鼠時,可顯著減少PC3M-LN4(人類前列腺癌)腫瘤生長 體內 。這些相同的腫瘤顯示血管密度降低了 70-80%。向腫瘤注射外源高分子量的 HA16 後,腫瘤生長得以恢復。16
血管生成
HA寡糖能促進血管生成,而高分子量的HA則會延緩血管生成。16,17,19,20 除了HA片段和聚合物影響血管生成外,透明質酸酶水平和HA降解與腫瘤生長和血管生成相關。因此,推論腫瘤 HA 的降解會產生 HA 低聚糖,進而刺激血管生成和腫瘤生長。這個理論有一些矛盾的資訊,顯示要完全了解 HA 與血管生成之間的複雜關係,還需要更多的研究。16
透明質酸的降解。玻尿酸的降解
玻尿酸從生物體內移除有兩種途徑,都需要玻尿酸酶10,20:
1.細胞內化和降解,並在淋巴體中破壞10:
透明質酸酶Hyal-1負責細胞內HA的分解,主要在淋巴體中發揮作用。10,20 This is the enzyme that creates angiogenic HA fragments since it cleaves HA chains of all sizes down to tetrasaccharides,
透明質酸酶,Hyal-1,負責細胞內HA的分解,主要在淋巴體中發揮作用。20-15 由 Hyal-1 產生的四糖的降解是由淋巴體中的β-葡萄糖醛酸酵素和β-N-乙酰葡糖胺酵素完成。最後的降解產物是 GlcNAc (可以回收) 和 GlcA (在戊糖途徑中分解)。6
2.從 ECM 中釋放並引流到血管中,然後由淋巴結、肝臟和腎臟清除10:
透明質酸酶 Hyal-2 負責分解細胞外 HA。10,20 HA 被裂解後,會經由淋巴系統轉運。一旦進入血流,肝臟會清除約 80%,腎臟會清除另外 10%。10
酶7
消化 HA 的透明質酸酶有三種分類:
- 哺乳動物(內β-N-乙酰基-D-己糖胺酶,可製造四糖和六糖)
透明質酸酶在酸性 pH 值下功能最佳,考慮到其在溶酶體降解中的作用,這是意料之中的。酵素消化通常在醋酸鈉緩衝液 (pH 4.8-6.0) 中於 37 °C 下進行。通過改變消化時間,所得到的 HA 寡糖池會發生變化 - 消化時間越長,鏈長越短。
在人類基因組中編碼有 5 種同源的哺乳類透明質酸酶:Hyal-1 至 4 和 PH-20(精子黏附分子 1,或 SPAM-1)。20
- Hyal-1在大多數組織中表達,也可在血漿和尿液中檢測到。Hyal-1 不與膜結合;然而,它需要 CD44 來提供透明質酸酶的活性 在體內。20
- Hyal-2也在大多數組織中表達;然而,大腦中沒有。它能分解細胞外的 HA。它具有糖基磷脂酰肌醇 (GPI) 訊號序列,可將其固定於膜上。Hyal-2也需要CD44才能降解HA 在體內,20 它被認為是一種細胞外的酵素,是組織重塑和細胞移動的關鍵。10
- Hyal-3在腦部和其他幾種組織中表達,但其功能尚未確定。20
- Hyal-4 對硫酸軟骨素底物具有特異性,並且是 GPI 錨定的。20
- PH-20 在精子中表達,並且在受精過程中活躍,它會降解卵子中富含 HA 的積聚物。10,20
化學7
HA 也可以透過非酶的方式降解。導致鏈長度變短的最常見條件有
- 酸性條件
- 鹼性條件
- 物理應力(高速攪拌或臨界剪切)
- 聲化
透明質酸合成
HA是由稱為透明質酸合成酶(HAS)的酵素製成。HA 在質膜上合成,聚合物從還原端延伸,導致其從細胞表面擠出。12 CD44表達的細胞會以細胞包膜的形式保留合成的HA。11 用於生產 Glycosil® ha 和 HyStem® hydrogels是利用來自 Streptococcus equisimilis的重組hasA基因合成,該基因在 Bacillus subtilis中表達。所得的 HA 在 1 MDa 的範圍內。26
Glycosil® HA vs.未改良的 HA
未改良的 HA 難於使用(黏度高),無法形成穩定的水凝膠(高濃度時可製成凝膠狀溶液,尤其是高分子量的 HA,但沒有化學交聯),而且 HA 在體內會被內源性透明質酸酶快速降解 。2,9
Glycosil® HA 是在每個 HA 聚合物的 COOH 或 OH 基上引入多個硫醇分子而形成的。12 這些硫醇基團可以彼此反應形成二硫鍵,也可以與 PEGDA 共價反應,形成穩定 4-8 週的水凝膠&。nbsp;在體內,22-25 但仍會被透明質酸酶降解。
透明質酸的歷史
1934 -透明質酸的歷史。/b> - HA首次從牛眼睛的玻璃體中分離出來,並從hyaloid(=玻璃體)和uronic acid中命名&。nbsp;
1930-40s - HA 從滑膜液、皮膚、臍帶、腫瘤和公雞梳子中分離出
1951 -確定HA的化學結構
1970 年代 -軟骨蛋白多糖被證實與HA有特異性的相互作用
1993 年- ;從A群鏈球菌中發現並克隆透明質酸合成酶
1999 - 首次純化活性透明質酸合成酶
現在- HA的生產現在主要通過細菌發酵
Network error: Failed to fetch
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?為便利客戶閱讀,此頁面中文以機器翻譯完成。雖然我們已盡力確保機器翻譯的準確性,但機器翻譯並非完美。如果您對機器翻譯的內容不滿意,請參考英文版本。