Wskazówki dotyczące protokołów immunofluorescencji
Czytaj więcej o
- Barwienie immunologiczne przeciwciałami fluorescencyjnymi
- Fluorescencyjna immunodetekcja dla ICC: Krok po kroku
- Wybór przeciwciał i fluoroforów
- Dodatkowe rozważania przy wyborze fluoroforów
- Program ochrony fluorescencji: Przedłużenie żywotności przeciwciał fluorescencyjnych i odczynników
- Wybór przeciwciał: Technika barwienia
- Wybór przeciwciał: on-target, specyficzna reaktywność
- Kontrole eksperymentalne dla IF-ICC
- .Insider Advice for Getting the Best Signal-and Conquering Background-with IF-ICC
- Powiązane produkty
Barwienie immunologiczne z przeciwciałami fluorescencyjnymi
Zastosowania immunofluorescencji (IF) - gdzie przeciwciało jest sprzężone z przeciwciałem fluorescencyjnym.gdzie przeciwciało jest sprzężone z cząsteczką, która fluoryzuje po wzbudzeniu laserem - obejmują lokalizację białka, potwierdzenie modyfikacji potranslacyjnej lub aktywacji oraz bliskość / łączenie się z innymi białkami. Immunocytochemia (ICC) jest dobrze ugruntowaną techniką, która wykorzystuje przeciwciała do wiązania się z celami w próbkach komórek, a Coons et al po raz pierwszy opisał immunodetekcję przy użyciu fluorescencyjnej cząsteczki reporterowej w 1942 roku.Oprócz dostarczania informacji o celach subkomórkowych, połączenie immunofluorescencji z immunocytochemią daje jedne z najbardziej atrakcyjnych danych wizualnych w naukach przyrodniczych. W tym przewodniku naukowcy zajmujący się przeciwciałami dzielą się tym, czego nauczyliśmy się o uzyskiwaniu najlepszego możliwego obrazu z eksperymentów IF-ICC.
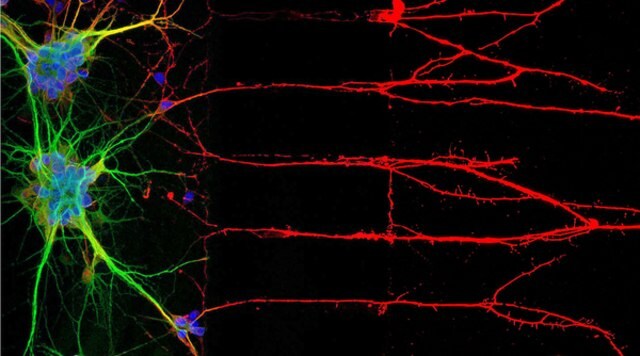

Rysunek 1: Immunocytochemia (ICC) lokalizuje białka związane z jądrami neuronów, soma i aksonami (po lewej). Po prawej, barwienie immunofluorescencyjne ludzkiej linii komórkowej U-251 MG.

Rysunek 2.Immunodetekcja fluorescencyjna
Optymalizacja niektórych etapów protokołu immunofluorescencji może być konieczna w celu uzyskania najlepszych wyników w oparciu o czynniki, które obejmują subkomórkową lokalizację celu i charakterystykę antygenu.
Przygotowanie próbek:
Niezależnie od formatu wzrostu komórek, udane obrazowanie IF-ICC rozpoczyna się od zebrania zdrowych próbek o odpowiedniej gęstości hodowli.
Zawiesina komórek:
Rodzaje komórek mogą być płukane w celu usunięcia pożywki i ponownie zawieszane, a następnie barwione w probówkach o małej objętości przed zamontowaniem na szkiełkach do badania mikroskopowego. Zawiesiny należy najpierw zbadać mikroskopowo pod kątem morfologii i nie powinny przekraczać zalecanej konfluencji / miana dla linii komórkowej, aby można je było uznać za odpowiednie do immunocytochemii. Zdrowe, subkonfluentne hodowle nie będą nadmiernie zmętniałe ani nie będą wykazywać zażółcenia wskazującego na zakwaszenie pożywki. Komórki powinny wydawać się jasne i zaokrąglone w badaniu mikroskopowym. Procentową żywotność można określić za pomocą hemocytometru i wykluczenia błękitu trypanu. Po płukaniu komórki powinny być ponownie zawieszone w ilości 1 -2 x 106 komórek/ml, czy to do barwienia ICC w roztworze, czy też do nakładania rozmazu w celu późniejszego barwienia na szkiełkach specjalnie przygotowanych do zwiększonej adhezji komórek.
Kiedy komórki adherentne są hodowane (i być może poddawane obróbce) w celu zbadania wpływu na ekspresję celu przez IF-ICC, komórki mogą być wysiewane na szkiełka komorowe, które są szkiełkami zoptymalizowanymi do obrazowania optycznego z jedno- lub wielokomorowymi nadbudowami, które umożliwiają dodawanie pożywki do hodowli. Szkiełka komorowe umożliwiają bezpośrednie przejście od hodowli komórkowej do sondowania i obrazowania. Adherentne typy komórek mogą być również wysiewane na szkiełka nakrywkowe mikroskopu zanurzone w studzienkach wypełnionych pożywką, które są następnie barwione i montowane na szkiełkach w celu obrazowania.
Niezależnie od powierzchni hodowli i podejścia do naczyń, wzrost komórek na szkiełkach nakrywkowych lub w komorach szkiełek mikroskopowych powinien być uważnie monitorowany, tak aby komórki mogły zostać usunięte z hodowli i utrwalone do immunocytochemii przed ich przerośnięciem.Komórki są często obrazowane, gdy konfluencja (ilość powierzchni pokrytej przez komórki) mieści się w zakresie 50-80%.Jeśli żywotność komórek musi zostać ostatecznie określona przed barwieniem immunologicznym, niektórzy badacze używają barwników takich jak homodimerethidium, marker jądrowy, który nie może przekroczyć granicy jądra komórkowego.marker jądrowy, który nie może przekroczyć nienaruszonych błon komórkowych żywych komórek - więc barwienie DAPI, które fluoryzuje w jądrach zarówno żywych, jak i nieżywotnych komórek, może pomóc w ilościowym określeniu procentowej żywotności jako liczby jąder zabarwionych etydyną / liczby podwójnie zabarwionych jąder. Alternatywnie, dostępne są komercyjne zestawy żywych/martwych komórek, które często wykorzystują odpowiednio kalceinę i jodek propidyny do odróżnienia żywych od martwych komórek.
Utrwalanie:
Utrwalanie i permeabilizację można osiągnąć w jednym etapie za pomocą utrwalaczy organicznych, takich jak alkohol i aceton. Rozpuszczalniki organiczne nie powinny być jednak stosowane, gdy konieczne jest zachowanie integralności lipidów, tak jak w przypadku, gdy docelowy antygen jest związany z błoną.Chociaż formaldehyd (często sprzedawany i stosowany w postaci polimerycznej paraformaldehyd) jest powszechnym wyborem, który zatrzymuje rozkład i utrwala białka w miejscu, aldehydy sieciujące mogą utrudniać dostęp przeciwciał do niektórych antygenów i dlatego powinny być stosowane w najniższym stężeniu, które skutecznie zachowuje strukturę po 10-20 minutach inkubacji, zwykle między 1-4% dla (para)formaldehydu.UWAGA: Ponieważ jest źródłem autofluorescencji, najlepiej unikać aldehydu glutarowego w protokołach utrwalania IF.
Pobieranie antygenu:
Niektóre docelowe epitopy mogą być maskowane przez kompleksowanie w zatłoczonym mikrośrodowisku komórkowym lub przez techniki utrwalania.Wykazano, że techniki odzyskiwania antygenu zwiększają dostęp przeciwciał do niektórych docelowych antygenów, ale powinny być stosowane z najwyższą ostrożnością i wstępnie przetestowane podczas pracy z komórkami na szkiełkach, ponieważ warunki cieplne lub chemiczne, na które narażone są komórki, są zazwyczaj zbyt trudne dla próbek ICC.
Permeabilizacja:
Detergenty Triton-X lub Tween-20 są powszechnie stosowane do skutecznej permeabilizacji utrwalonych komórek, ale detergenty te bezkrytycznie rozpuszczają lipidy i mogą być bardziej destrukcyjne niż saponina, glikozyd roślinny, który perforuje błonę poprzez selektywne rozpuszczanie cholesteroli, pozostawiając błony organelli zasadniczo nienaruszone. Jeśli cel zainteresowania znajduje się w strukturach związanych z błoną wewnątrz komórki, bardziej odporne detergenty, takie jak Triton-X, Tween-20, detergenty Brij lub NP-40, z większym prawdopodobieństwem zapewnią dostęp do przeciwciała. Saponina jest łagodniejszym permeabilizatorem, który zachowuje integralność antygenów powierzchniowych, ale może nie być odpowiednia do permeabilizacji błon wewnątrzkomórkowych w celu zapewnienia dostępu przeciwciał do celów w jądrze lub innych organellach. Ponieważ działanie saponiny może być odwracalne, a zatem utracone podczas płukania, jej stosowanie powinno być utrzymywane przez cały protokół barwienia, aby zapewnić dostęp przeciwciał.
Blokowanie:
Roztwór do 5% normalnej surowicy z gatunku, w którym wyhodowano przeciwciało wtórne, skutecznie zablokuje jego niespecyficzne wiązanie. Jeśli surowica nie jest dostępna, podejściem, które dostosowuje się do każdego przeciwciała drugorzędowego, jest użycie bardziej ogólnego blokera białkowego, takiego jak albumina surowicy bydlęcej (BSA) w podobnym rozcieńczeniu w PBS. Niektóre laboratoria używają kombinacji surowicy i BSA, aby osiągnąć zarówno specyficzne dla gospodarza przeciwciała, jak i ogólne blokowanie. BSA jest często dostarczana w postaci liofilizowanej i odtworzonej do postaci płynnej, więc powinna być filtrowana i/lub regularnie sprawdzana pod kątem cząstek stałych, które mogą osadzać się na próbkach, tworząc artefakty barwienia. Blokowanie może być utrzymywane przez cały czas trwania protokołu immunofluorescencji poprzez rozcieńczanie przeciwciał w buforze blokującym.
Wybór przeciwciał i fluoroforów
Wybór fluoroforów
.Przy planowaniu każdego eksperymentu fluorescencyjnego badającego komórki metodą ICC, zawsze należy w pierwszej kolejności rozważyć konfigurację optyczną mikroskopu, który ma być użyty do analizy.Protokoły IF-ICC mogą być używane do znakowania pojedynczego celu, ale wiele konfiguracji mikroskopów fluorescencyjnych może pomieścić multipleksowanie lub jednoczesne barwienie kilku celów wraz z jądrem. Przykładowa paleta eksperymentalna do barwienia trzech celów i jądra jest pokazana poniżej:
Mikroskopy fluorescencyjne mają unikalne konfiguracje wzbudzania i emisji. Mikroskopy są fabrycznie wyposażone w źródła światła o wysokiej intensywności, takie jak lampy łukowe lub lasery, które emitują światło o określonej długości fali zdolnej do wzbudzenia kompatybilnych fluoroforów. Zestawy filtrów wychwytują zakres długości fal światła emitowanego przez wzbudzone fluorofory, który może być szeroki, aby zmaksymalizować wychwyconą emisję, lub wąski, aby zoptymalizować specyficzność i zmniejszyć nakładanie się kanałów emisji. Powyższa tabela została przedstawiona jako przykład oparty na typowych konfiguracjach mikroskopów fluorescencyjnych. Należy zapoznać się z konfiguracjami lasera i filtrów urządzenia, aby wybrać najlepsze przeciwciała sprzężone z fluoroforami dla danego protokołu immunofluorescencji ICC lub IHC. Naukowcy zajmujący się rdzeniem mikroskopii są często pomocni w projektowaniu eksperymentów IF.
Dodatkowe aspekty przy wyborze fluoroforów
Fotostabilność: Fotobielenie, czyli nieodwracalne uszkodzenie fluoroforów wywołane światłem, wpływające na ich zdolność do fluorescencji, może wynikać z nadmiernej ekspozycji cząsteczek fluorescencyjnych na światło otoczenia lub wzbudzenia podczas mikroskopii. Wiele wszechobecnych fluoroforów, takich jak FITC i TRITC, jest szeroko dostępnych, ponieważ nie są one zastrzeżone i ze względu na ich długą żywotność na rynku - ale mogą być znacznie bardziej wrażliwe na fotowybielanie niż fluorofory późniejszej generacji, które wykorzystują inne chemikalia.
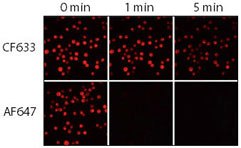
Rysunek 3.Względna fotostabilność koniugatów CF633 i Alexa Fluor 647 (AF647) kozich anty-mysich. Komórki Jurkat utrwalono, permeabilizowano i wybarwiono króliczym anty-CD3, a następnie koniugatami CF633 lub Alexa Fluor® 647 koziej anty-króliczej IgG. Próbki obrazowano przy użyciu mikroskopu z lampą rtęciową wyposażonego w zestaw filtrów Cy5 i kamerę CCD. Sekwencyjne obrazy rejestrowano po 0, 1 i 5 minutach.
Przy wytwarzaniu rozcieńczonych roztworów roboczych przeciwciał zawierających sondę fluorescencyjną należy rozważyć rozcieńczenie tego roztworu roboczego w pojemniku chroniącym przed światłem, takim jak bursztynowa fiolka. Roztwory robocze są często narażone na działanie światła przez dłuższy czas niż przechowywane roztwory podstawowe lub komercyjne preparaty przeciwciał, więc ten dodatkowy środek, który zmniejsza ekspozycję na światło, może zapewnić dodatkową ochronę w scenariuszach użytkowania.
Fluorescence Protection Program: Przedłuż żywotność przeciwciał i odczynników fluorescencyjnych
Odczynniki fluorescencyjne mogą wymagać specjalnego przechowywania i obsługi, aby zachować fotostabilność jednostki fluorescencyjnej, a także integralność funkcjonalną samego przeciwciała. Upewnij się, że odczynnik jest dostarczany w warunkach temperaturowych określonych w dokumentach wysyłkowych dostawcy i przenieś go do laboratorium zalecanego przez producenta, aby nie pogorszyć warunków świetlnych i temperaturowych. Pobranie zapasu przeciwciał po dostarczeniu do mniejszych objętości (z powielonym oznakowaniem) chroni integralność odczynnika, ograniczając liczbę razy, gdy roztwór podstawowy jest narażony na zamrażanie, rozmrażanie, zmiany temperatury w wiadrze z lodem lub inne zmiany temperatury lub światło otoczenia.
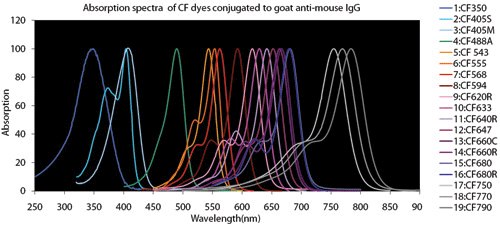
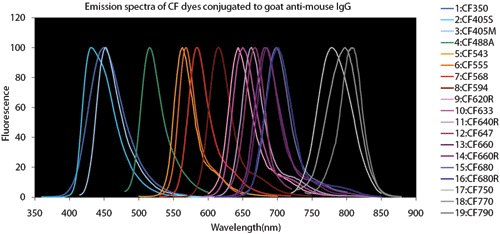
Rysunek 4.Wykresy porównawcze barwników fluorescencyjnych
Nakładanie się widm: Podczas przeprowadzania eksperymentów multipleksowych w celu wykrycia wielu celów w tej samej próbce, należy zapoznać się z charakterystyką widmową fluoroforów, długościami fal lasera i zakresami filtrów mikroskopowych. Konfiguracje filtrów emisyjnych mikroskopu powinny być dobrane tak, aby zmniejszyć nakładanie się widm, ale dobrą praktyką jest wybór fluoroforów, które nie mają długich "ogonów" emisji, które mogą przedostawać się do sąsiedniego kanału filtra.

Rysunek 5.Względna fluorescencja CF543 i Alexa Fluor 546 (AF546) kozich koniugatów anty-mysich jako funkcja liczby cząsteczek barwnika na białko (stopień znakowania).
Antibody Selection: Technika barwienia
Wybór przeciwciał
Barwienie bezpośrednie: Niektórzy badacze mogą docenić wygodę podejścia "barwienia bezpośredniego", w którym przeciwciało pierwotne jest bezpośrednio sprzężone z fluoroforem, ponieważ wiązanie i detekcja fluorescencyjna są osiągane w jednym kroku, a całkowity czas potrzebny do ukończenia protokołu IF-ICC jest skrócony.Bezpośrednie koniugaty ułatwiają również multipleksowe barwienie wielu celów w tej samej próbce, eliminując potrzebę wyboru przeciwciał pierwotnych od różnych gospodarzy w celu uniknięcia reaktywności krzyżowej (więcej o multipleksowym IF-ICC, poniżej).
Jeśli używany jest koniugat przeciwciała pierwotnego, etap ten należy przeprowadzić w ciemności, aby chronić fluorofor przed fotowybielaniem. Po inkubacji z pierwotnym koniugatem protokół można natychmiast przejść do płukania i montażu. Koktajl przeciwciał może być użyty do barwienia wielu celów w próbce w jednym kroku.
Bezpośrednia metoda barwienia: W "pośredniej" immunodetekcji, po nieznakowanym przeciwciele pierwotnym specyficznym dla celu następuje następnie przeciwciało wtórne sprzężone z fluoroforem, które wykrywa gatunek gospodarza przeciwciała pierwotnego. Technika ta daje wyraźną przewagę wzmocnienia sygnału, ponieważ istnieje możliwość, że wiele przeciwciał wtórnych zawierających fluorofor może wiązać przeciwciało pierwotne, zwiększając liczbę cząsteczek emitujących fluorescencję w miejscu antygenu.
Multipleksowe namierzanie wielu antygenów jednocześnie w tej samej próbce wymaga dodatkowych rozważań dotyczących metody wykrywania pośredniego, jak wyjaśniono poniżej.
Wybór przeciwciał: docelowa, specyficzna reaktywność
Pierwotne przeciwciało:
Podczas wykrywania pośredniego przeciwciała będą stosowane w koktajlu do eksperymentów multipleksowych, zarówno na etapie inkubacji pierwotnej, jak i wtórnej. Dlatego ważne jest, aby wybrać pierwotne przeciwciała dla każdego celu, które zostały wyhodowane w innym gospodarzu. Zapewnia to, że każde sprzężone przeciwciało w drugorzędowym koktajlu wiąże się z unikalnym pierwotnym przeciwciałem w próbce. Niewybranie unikalnych gospodarzy dla każdego przeciwciała docelowego spowoduje, że wyniki barwienia będą niemożliwe do zinterpretowania. Poniżej znajduje się przykładowa konfiguracja eksperymentalna dla multipleksowego wykrywania pośredniego:
W tym przykładzie, jeśli badacz zamiast tego wybrałby pierwotne przeciwciało królicze anty-B, zarówno anty-A, jak i anty-B byłyby ukierunkowane przez wtórny koniugat anty-króliczy, a oba cele A i B byłyby oznaczone zielonym sygnałem fluorescencyjnym.
Reaktywność krzyżowa przeciwciało pierwotne-tkanka: Wybierając przeciwciała do barwienia pośredniego, zaleca się odznaczenie wszelkich przeciwciał pierwotnych hodowanych w tym samym gospodarzu, z którego pochodzi próbka - na przykład, nie należy używać mysiego przeciwciała pierwotnego na mysiej tkance. Podążanie za przeciwciałem wtórnym przeciw mysiem prawdopodobnie spowodowałoby powszechne wiązanie przeciwciała wtórnego bezpośrednio z tkanką, powodując znaczne zabarwienie tła. Chociaż sprzedawane są zestawy, które mają na celu blokowanie reaktywności gospodarz-samiec, najbardziej ryzykownym sposobem działania jest unikanie reaktywności gospodarz-samiec przy wyborze przeciwciał pierwotnych do protokołów pośrednich. UWAGA: reaktywność krzyżowa gospodarz-samiec zasadniczo nie stanowi problemu w przypadku metod bezpośredniego barwienia.
Przeciwciało wtórne:
Jak wyjaśniono powyżej (Wybór przeciwciał: technika barwienia, metoda pośrednia, powyżej) "pośredni" IF-ICC umożliwia wzmocnienie sygnału, ponieważ wiele przeciwciał wtórnych może wiązać przeciwciała pierwotne związane z celem. Ale pośrednia metoda IF-ICC pozwala również laboratorium na zbudowanie modułowej biblioteki przeciwciał drugorzędowych które będą kompatybilne z rosnącą kolekcją przeciwciał pierwszorzędowych, tak aby każdy cel mógł być przypisany do dowolnego dostępnego kanału filtra mikroskopu.
Płukanie:
Płukanie po każdym zastosowaniu przeciwciała lub innej sondy fluorescencyjnej eliminuje przeciwciała o niższym powinowactwie wiązania obecne w próbce, a tym samym zmniejsza niespecyficzny sygnał lub reaktywność krzyżową. Nie można przecenić znaczenia etapu płukania. Płukanie przez kilka minut w PBS z co najmniej dwukrotną wymianą buforu pomoże wyeliminować niezwiązane i luźno związane przeciwciało z próbki.
Dłuższe płukanie może nie przynieść zauważalnych korzyści w zakresie redukcji tła, ale generalnie nie jest szkodliwe, o ile wydłużony czas w buforze nie odrywa próbki od szkiełka lub szkiełka nakrywkowego. Bardzo krótkie płukania z mniejszą liczbą powtórzeń mogą nie usunąć skutecznie przeciwciała, które nie jest specyficznie związane z celem, co może prowadzić do słabego stosunku sygnału do tła.
Barwienie jądrowe i montaż:
Wielu badaczy wykonujących IF-ICC może chcieć użyć odczynnika fluorescencyjnego, który oznacza jądro komórkowe, takiego jak DAPI lub Hoechst.Ponieważ oba te odczynniki ulegają interkalacji i stają się fluorescencyjne w ciągu kilku sekund od uzyskania dostępu do DNA, podłoże montażowe zawierające DAPI może być użyte do uzyskania barwienia jądrowego i montażu w jednym kroku. Oszczędza to czas, eliminując potrzebę oddzielnego barwienia DAPI/Hoechst i etapów płukania, a także zmniejsza zmienność stężenia i czasu inkubacji kontrbarwnika jądrowego.
Wszystkie media montażowe pomagają przymocować szkiełko nakrywkowe do szkiełka i zachować próbkę do mikroskopii, zapobiegając odwodnieniu. Wiele podłoży montażowych jest również opracowanych w celu optymalizacji współczynnika załamania światła dla mikroskopii i może zawierać środki, które chronią fluorofory związane z barwioną próbką przed fotobieleniem.
Kontrole eksperymentalne dla IF-ICC<Podobnie jak w przypadku innych eksperymentów, włączenie kontroli pozytywnych i negatywnych zwiększy zaufanie do czułości i specyficzności wyników fluorescencyjnego ICC.
Kontrole dla eksperymentów IF-ICC mogą obejmować:
Pomiń pierwotne:
Prostą kontrolą, którą można łatwo włączyć do każdego eksperymentu ICC, jest pominięcie pierwotnego przeciwciała na etapie pierwotnego barwienia w protokole immunodetekcji pośredniej. Pokazuje to, czy jakikolwiek zaobserwowany sygnał może być spowodowany niespecyficznym wiązaniem fluorescencyjnego przeciwciała wtórnego bezpośrednio z próbką.
Kontrola izotypu:
W przypadku bezpośredniego barwienia sprzężonymi przeciwciałami pierwotnymi, próbka, w której kontrola izotypu sprzężona z tym samym fluoroforem zastępuje koniugat pierwotny, pomaga upewnić się, że jakikolwiek zaobserwowany sygnał jest spowodowany swoistością przeciwciała pierwotnego dla antygenu. Kontrole izotypowe są często dostępne u dostawcy koniugatu przeciwciała i należą do tej samej klasy i typu immunoglobulin co przeciwciało przeciwko antygenowi, ale nie mają swoistości dla żadnego znanego epitopu. Izotypy służą jako kontrola dla pierwotnego przeciwciała, ponieważ ich włączenie pokazuje, że obserwowany sygnał nie jest spowodowany samą "lepkością" samego białka pierwotnego przeciwciała.
Komórki ujemne dla antygenu docelowego:
Rodzaj komórek może nie wykazywać ekspresji antygenu będącego przedmiotem zainteresowania i może służyć jako ujemna próbka kontrolna.Alternatywnie, komórki z celem zainteresowania genetycznie zmodyfikowane tak, że białko zainteresowania nie ulega ekspresji (knock-out komórki) są solidną kontrolą specyficzności celu, jeśli są dostępne. Techniki modyfikacji genetycznej, takie jak CRISPR/Cas nuclease mogą być wykorzystane do wyeliminowania ekspresji białka docelowego w celu stworzenia linii komórek z kontrolą negatywną.
Komórki pozytywne dla antygenu docelowego:
Jeśli dostępne są komórki, w których wcześniej wykazano ekspresję antygenu będącego przedmiotem zainteresowania, czy to endogennie, czy poprzez modyfikację w celu "knock in" lub nadekspresji genu, mogą one służyć jako kontrola pozytywna, aby potwierdzić, że protokół barwienia wytwarza sygnał, gdy cel jest obecny w próbce.
Insider Advice for Getting the Best Signal-and Conquering Background-with IF-ICC
- O ile to możliwe, wybieraj przeciwciała, dla których dostępne są dane potwierdzające wyniki w zastosowaniach ICC
- Dopasuj charakterystykę spektralną przeciwciał fluorescencyjnych do laserów i filtrów mikroskopowych
- Utrwalaj próbki komórek, które są zdrowe, wolne od zanieczyszczeń i osadów oraz subkonfluentne
- Optymalna metoda utrwalania i permeabilizacji zależy od celu i jego lokalizacji subkomórkowej
- Rozcieńczyć przeciwciała w buforze blokującym, aby utrzymać blokowanie w całym protokole barwienia
- Bezpośrednia detekcja za pomocą fluorescencyjnego przeciwciała wtórnego pozwala na wzmocnienie sygnału
- Wybierając spośród koniugatów przeciwciał o podobnej charakterystyce spektralnej, należy wybrać bardziej stabilny fluorofor, aby uniknąć fotobielenia podczas długich lub powtarzających się ekspozycji mikroskopu - i uniknąć nakładania się widm
- Zawsze dołączaj odpowiednie kontrole barwienia.Używaj pozytywnych i negatywnych kontroli biologicznych, jeśli są dostępne.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?