Ligandy Trost do alkilowania allilowego
Katalizowana palladem asymetryczna alkilacja allilowa (AAA) jest skuteczną metodą efektywnej budowy centrów stereogenicznych. W przeciwieństwie do wielu innych metod katalitycznych, AAA ma zdolność do tworzenia wielu rodzajów wiązań (C-C, C-O, C-S, C-N) za pomocą jednego układu katalitycznego.
Czytaj więcej o
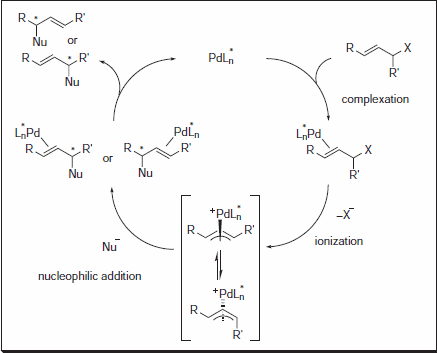
Rysunek 1.Addycja nukleofilowa
Grupa Trost z Uniwersytetu Stanforda jest pionierem w stosowaniu symetrycznych ligandów diaminocykloheksylowych (DACH) w AAA, co pozwala na szybką syntezę różnorodnych produktów chiralnych przy ograniczonej liczbie transformacji chemicznych. Reakcje są zazwyczaj wysokowydajne i obserwuje się doskonały poziom enancjoselektywności.1
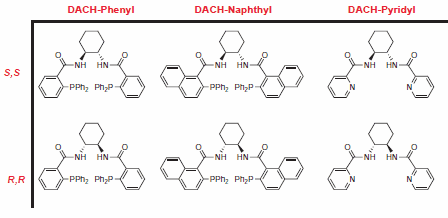
Rysunek 2.Ligandy Trost
Nukleofile węglowe
We wczesnych przykładach tej metodologii, Trost i współpracownicy wykazali, że diestry są kompetentnymi nukleofilami do deracemizacji cyklicznych octanów allilowych, w celu uzyskania chiralnych pochodnych malonianu. Od tego czasu miękkie nukleofile węglowe, takie jak pochodne kwasu barbiturowego, estry β-keto, związki nitrowe i wiele innych, zostały wykorzystane w AAA do montażu trzeciorzędowych i czwartorzędowych centrów asymetrycznych.
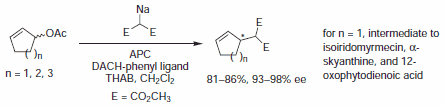
Rysunek 3.Nukleofile malonianowe
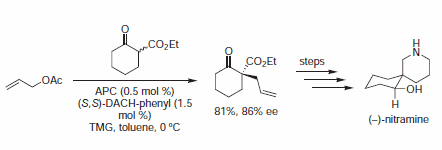
Rysunek 4.Nukleofile β-ketoestrowe
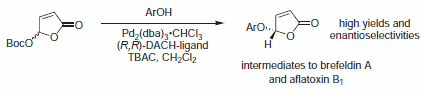
Rysunek 5.Nukleofile alkoholowe
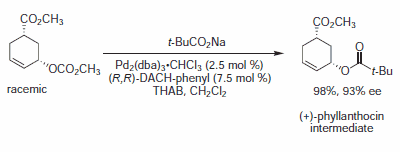
Rysunek 6.Nukleofile karboksylanowe
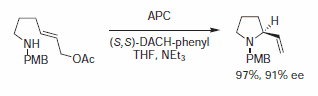
Rysunek 7.Alkiloaminy Nukleofile
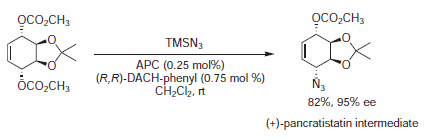
Rysunek 8.Nukleofile azydkowe
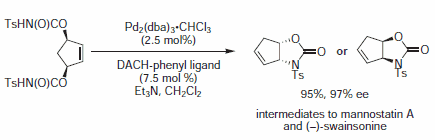
Rysunek 9.Nukleofile imidowe
Reakcje katalizowane molibdenem
.Zakłada się, że mechanizm reakcji AAA katalizowanej molibdenem jest wyraźnie różny od analogicznej reakcji katalizowanej Pd, a w niektórych przypadkach poziomy regio-, enancjo- i diastereoselektywności są zwiększone w stosunku do reakcji katalizowanej palladem. Trost i Dogra donoszą o całkowitej syntezie (-)-Δ9-trans-tetrahydrokannabinolu, psychomimetycznego marihuany, z wykorzystaniem katalizatora molibdenowego.9 Ogólna wydajność 30% enancjomerycznie czystego (-)-Δ9-trans-tetrahydrokannabinolu (Rysunek 10).
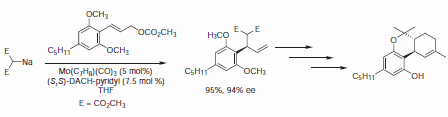
Rysunek 10.Reakcje katalizowane molibdenem
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?