Wprowadzenie
Hashmi, Toste, Echavarren i Haruta, między innymi, napędzili rozwój złota w czołówce katalizy metali przejściowych.1,2 Ligowane fosfiną kompleksy złota(I) stały się potężnymi katalizatorami tworzącymi wiązania C-C, C-N i C-O ze względu na łatwość, z jaką mogą aktywować wiązania C=C i C=C, umożliwiając w ten sposób unikalne przegrupowania lub reakcje z różnymi nukleofilami. Kataliza złotem zapewnia doskonałą metodę konstruowania złożonych architektur chemicznych w łagodny sposób, który byłby trudny do osiągnięcia przy użyciu innych paradygmatów reakcji. Jak zilustrowano poniżej, aktywne katalizatory są zwykle przygotowywane przez dodanie aktywatora srebra do prekatalizatora halogenku złota, chociaż istnieją przykłady izolowalnych katalizatorów złota.

Z dumą oferujemy skarbnicę złotych prekatalizatorów i soli srebra, a także obszerne portfolio nienasyconych bloków budulcowych, aby przyspieszyć sukces badań w tej ekscytującej dziedzinie.
Zalety
- Katalizatory łatwo aktywują alkeny, alkiny i alkeny w niezliczonych transformacjach
- Promują procesy regio-, diastereo- i enancjoselektywne
- Katalizatory są zazwyczaj stabilne w powietrzu i wodzie, a reakcje mogą być przeprowadzane w "otwartej kolbie"
- Wyjątkowa tolerancja grup funkcyjnych
- Wyłączność rynkowa dla wybranych złotych katalizatorów
Reprezentatywne zastosowania
Przegrupowanie octanów allilowych
Marion i wsp. opisali katalizowaną izomeryzację octanów allilowych. Wykorzystując kompleks złota z ligandem N-heterocyklicznego karbinu, naukowcy zgłosili pierwsze katalizowane złotem przegrupowanie allilowe. Aby zilustrować wszechstronność katalizatora, kilka octanów allilu zostało przegrupowanych z doskonałą wydajnością.

Rysunek 1.Przegrupowanie octanów allilowych
Izomeryzacja alenylowych estrów karbinolu
Buzas i wsp. opisali syntezę serii 1,3-butadien-2-oli z różnych alenów przy użyciu kompleksu złota jako katalizatora. Butadienowe bloki budulcowe są interesujące dla reakcji Dielsa-Aldera, [4+1] cykloaddycji i asymetrycznego uwodornienia. Katalizatorem wykorzystanym w tej reakcji jest kompleks złota z XPhos jako ligandem. Przy niskim obciążeniu wynoszącym 1 mol%, autorzy byli w stanie zsyntetyzować różne butadieny z wydajnością do 100%.

Rysunek 2.Izomeryzacja estrów allenylokarbinolu
Wewnątrzcząsteczkowe [4+2] cykloaddycje aryloalkinów lub 1,3-etenów z alkenami
Echavarren i współpracownicy opisali syntezę pochodnych piknantuchinonów A, katalizowaną przez [4+2] cykloaddycję dienynów. Wykorzystując stabilny krystaliczny kompleks złota oparty na ligandzie Buchwalda, naukowcy byli w stanie zsyntetyzować rodzinę pochodnych z dobrymi wydajnościami.
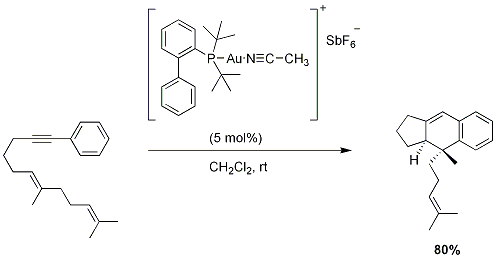
Rysunek 3.Cykloaddycje aryloalkinów
Cyklopropanowanie
Grupa Toste wykazała, że olefiny ulegają stereoselektywnemu cyklopropanowaniu (cis) z estrami propargylowymi w obecności generowanego in situ Ph<3PAuSbF6 i jest tym samym uzupełnieniem selektywności trans obserwowanej w katalizowanym metalami przejściowymi cyklopropanowaniu olefin przy użyciu α-diazooctanów.

Rysunek 4.Cyklopropanowanie
Izomeryzacja 1,6-enynów
Echavarren i inni badali różne katalizowane złotem cyklizacje 1,6-enynów z lub bez obecności nukleofili. Aktywne są różne katalizatory złota(I), w tym Ph3PAuCH3, Ph3PAuSbF6 oraz kompleksy Au[P(t-Bu)2(o-bifenylo)]SbF6 . Reakcje mogą tolerować heteroatomy zlokalizowane pomiędzy cząsteczkami olefiny i alkinu.
Izomeryzacja 1,5-enynów
Pod katalizą złota(I), 1,5-eneny o różnych wzorach podstawienia rearanżują się dając bicyklo[3.1.0]-hekseny z wysoką wydajnością i w sposób stereokontrolowany. W przypadku optycznie czynnych substratów reakcja może zachodzić z wydajnym przeniesieniem chiralności. Układ katalityczny wykorzystuje Ph3PAuCl w połączeniu z AgBF4, AgPF6 lub AgSbF6 aktywatorami.
Izomeryzacja 1,4-enynów (przegrupowanie Rautenstraucha)
Przegrupowanie Rautenstraucha 1,4-enynów zapewnia szybką drogę do zróżnicowanego portfolio funkcjonalizowanych cyklopentanonów. Chiralne piwalany 1-etynylo-2-propenylowe skutecznie rearanżują enancjoselektywnie w łagodnych warunkach. Można użyć Ph3PAuSbF6 lub Ph3PAuOTf (oba generowane in situ), w zależności od tożsamości substratów.
Cyclization of ε-Acetylenic Carbonyls (Conia-Ene Reaction)
Niekatalizowana reakcja Conia-ene zapewnia dostęp do metylenocyklopentanów bez potrzeby deprotonowania, jednak wymagane wysokie temperatury często skutkują zmniejszoną wydajnością. Toste i współpracownicy opisali łagodną katalityczną wersję tej reakcji, która przebiega w neutralnych warunkach w temperaturze otoczenia.
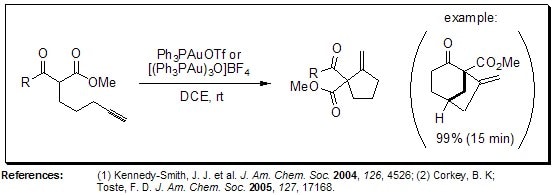
Rysunek 5.Reakcja Conia-ene
5-Endo-dig karbocyklizacje
Podczas gdy katalizowana złotem(I) cykloizomeryzacja Conia-enu jest ograniczona do terminalnych γ-alkinów, powiązana reakcja 5-endo-dig pozwala na cyklizację do niekońcowych δ-alkinów, zapewniając dostęp do pochodnych cyklopentenu. Ta syntetyczna metodologia może być stosowana do otrzymywania prostych bicyklicznych cząsteczek, jak również w syntezie heterocykli (poniżej) i halogenowanych cyklopentenów poprzez prekursory halogenków alkilowych.

Rysunek 6.Endo dig karbocyklizacje
Propargyl Claisen Rearrangement
Złoty katalizator [(Ph3PAu)3O]BF4 zapewnia dostęp do różnych alkoholi homoalkenowych poprzez szybką dwuetapową sekwencję przegrupowania Claisena eteru propargylowo-winylowego, a następnie redukcję funkcjonalności aldehydu. Reakcje są generalnie wysokowydajne, a solidny system katalizatora wykazuje również doskonałą zdolność do przekazywania chiralności rezydentnej do produktów allenowych.

Rysunek 7.Przegrupowanie propargilowo-claisenowskie
Stereoselektywna synteza dihydropiranów
Wykorzystując katalizę złotem(I), 2-podstawione dihydropirany są łatwo otrzymywane z propargilowych eterów winylowych w sposób stereokontrolowany.
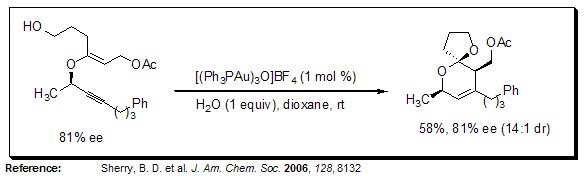
Rysunek 8.Stereoselektywna synteza dihydropiranów
Hydroaminacja alkenów i alkinów
Widenhoefer i He zbadali szereg katalizowanych złotem reakcji hydroaminacji alkenów i alkinów, przy czym badano zarówno warianty wewnątrz-, jak i międzycząsteczkowe. Stosując katalizatory Au(I) lub Au(III), można łatwo uzyskać aminy, pirolidyny, iminy i indole.

Rysunek 9.Hydroaminowanie alkenów i alkinów
Hydrofunkcjonalizacja allenów nukleofilami C, N i O
Winylowane tetrahydrofurany, tetrahydropirany, pirolidyny i piperydyny można łatwo otrzymać z odpowiednich alenów funkcjonalizowanych heteroatomem przy użyciu Au[P(t-Bu)2(o-bifenyl)]Cl i jednego z kilku aktywatorów srebrowych. Alternatywnie, indole na uwięzi allenowej mogą być wykorzystane do przygotowania pochodnych karbazolu.

Rysunek 10.Hydrofunkcjonalizacja allenów
Stereoselektywna synteza funkcjonalizowanych dihydrofuranów
Gagosz i współpracownicy przygotowali szereg 2,5-dihydrofuranów poprzez tworzenie półproduktu allenowego, a następnie cykloizomeryzację. Szybkie reakcje zachodzą w obecności Ph3PAuNTf2 i obserwuje się całkowite przeniesienie chiralności.

Rysunek 11.Stereoselektywna synteza funkcjonalizowanych dihydrofuranów
Ring Expansions of Alkynylcycloalkanols
1-Alkynylcycloalkanole szybko ulegają rearanżacji do odpowiednich 2-alkilidenocykloalkanonów w obecności kilku złotych katalizatorów. Wysokowydajne reakcje zapewniają pojedynczy izomer olefiny, gdy stosowane są wewnętrzne alkiny.

Rysunek 12.Rozszerzanie pierścieni alkilocykloalkanoli
Acetylenowa reakcja Schmidta
W obecności złotego katalizatora, pirole o różnych wzorach podstawienia mogą być otrzymywane w wewnątrzcząsteczkowej acetylenowej reakcji Schmidta azydków homopropargilowych.
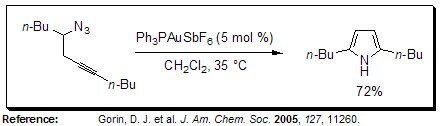
Rysunek 13.Acetylenowa reakcja Schmidta
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?