SuFEx: Fluorki sulfonylu, które uczestniczą w reakcji następnego kliknięcia
Wyposażenie w odczynnik ESF do łatwej instalacji SO2F
Wprowadzenie
Wymiana fluorku siarki (VI) (SuFEx) została zidentyfikowana jako następna reakcja chemii kliknięć ze względu na zrównoważone właściwości wiązania fluorku z wodorem i siarką (VI). We współpracy z K. Barrym Sharplessem, oferujemy obecnie różnorodne odczynniki fluorku sulfonylu, które przechodzą nowo zdefiniowaną reakcję chemii kliknięć.1 Bloki konstrukcyjne SuFEx zapewniają "łączącą" chemię, która znajdzie szerokie zastosowanie w takich zastosowaniach, jak synteza chemiczna, materiałoznawstwo, biologia chemiczna i opracowywanie leków.1-4

Advantages
Zgodnie z tradycyjną chemią typu click, SuFEx jest prostą, przyjazną dla wody i tlenu reakcją, która pozwala na uzyskanie wysokich wydajności przy niewielkim oczyszczaniu. Ponadto, fluorki sulfonylu mają charakterystyczny związek między stabilnością a reaktywnością ze względu na niektóre z następujących cech.1

1. Odporność na redukcję:W przeciwieństwie do innych halogenków, rozszczepienie fluorku sulfonylu jest heterolityczne, a zatem odporne na redukcję.1

2. Stabilność termodynamiczna:Fluorki sulfonylu są stabilne na termolizę, jak również na substytucję nukleofilową1 i wykazują w szczególności obojętną reaktywność w refluksie aniliny.2

3. Wyłączna reakcja na siarkę:Fluorki sulfonylu reagują szybko i, w porównaniu do chlorków sulfonylu, chemoselektywnie wytwarzają tylko produkty sulfonylacji.1

4. Szczególny charakter oddziaływania fluor-proton:Stabilizacja jonu fluorkowego w wodzie zapewnia chemię w środowisku wodnym.1

Wśród naszych dostępnych bloków budulcowych fluorku sulfonylu oferujemy fluorek etenosulfonylu (nr produktu 746959), ESF, akceptor Michaela dla nukleofili N, O, S i C. Dlatego grupa funkcyjna SO2F może być łatwo włączona do cząsteczek w celu odkrycia leków i zastosowań w biologii chemicznej. Wygenerowany fluorek sulfonylu jest niezwykle stabilny, ale łatwo reaguje z nukleofilami w odpowiednich warunkach do dalszej funkcjonalizacji lub zastosowania biochemicznego.1-2

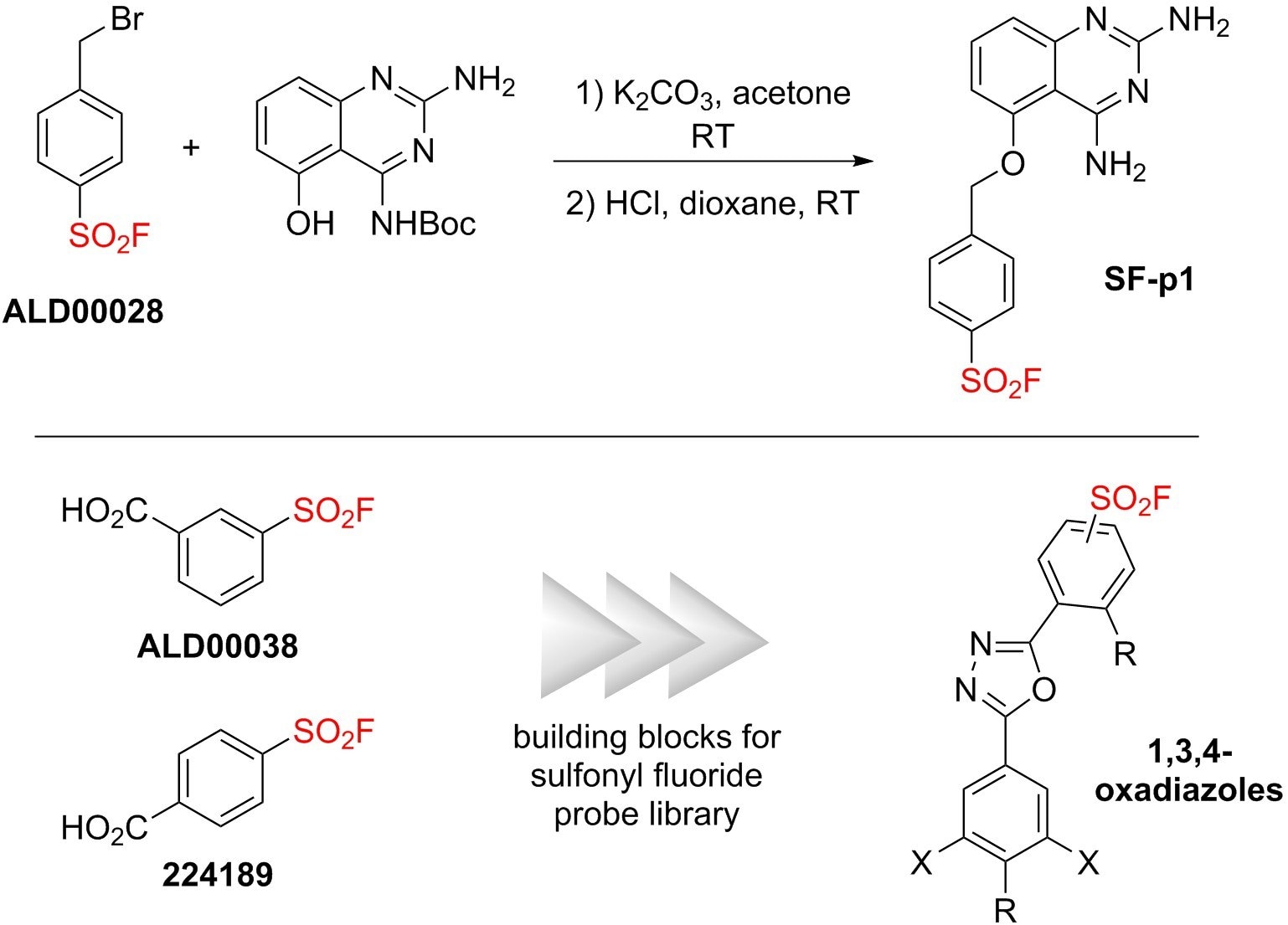
Inne bloki konstrukcyjne SuFEx zostały wykorzystane do wprowadzenia uchwytów SO2F do zastosowań w biologii chemicznej, takich jak sonda użyta przez Jonesa i współpracowników (SF-p1)5 oraz w bibliotece wygenerowanej przez Kelly'ego i jego współpracowników (1,3,4-oksadiazole).6
Biologia chemiczna i odkrywanie leków
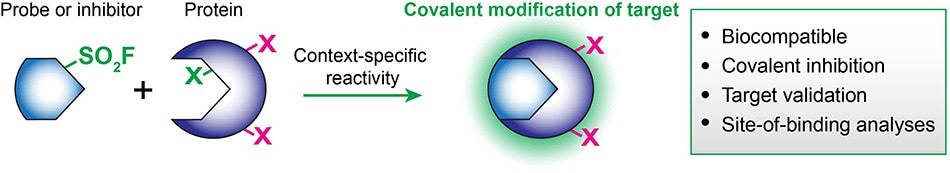
Po zintegrowaniu ze znanymi bioaktywnymi cząsteczkami, biokompatybilność i reaktywność fluorków sulfonylu zapewnia potężne narzędzia dla biologów chemicznych i twórców leków.4 Grupa SO2F kowalencyjnie modyfikuje wiele reszt białkowych, ale w sposób specyficzny dla kontekstu: serynę, treoninę, tyrozynę, lizynę, cysteinę i histydynę.4 W związku z tym, fluorki sulfonylu mogą być w unikalny sposób wykorzystywane w sondach chemicznych, kowalencyjnych inhibitorach lub na różnych etapach procesu translacji, w tym w walidacji celu i optymalizacji leadów/funkcjonalizacji końcowej
Niedawne przykłady funkcjonalizacji wcześniejszych inhibitorów i stabilizatorów enzymów za pomocą SO2F zaowocowały chemoselektywną modyfikacją interesujących nas białek: DcpS na Tyr,5 transtyretyny na Lys,6 i poliizoprenylowanej metylowanej esterazy białkowej na Ser.7 Inne znane inhibitory fluorku sulfonylu obejmują PMSF (P7626, 78830, 93482), AEMSF (76307, 15633, A8456) i FSBA (F9128).

Aby dowiedzieć się więcej o biologicznych zastosowaniach SuFEx, obejrzyj nasze webinarium z Lyn Jones z Pfizer! "Fluorki sulfonylu w biologii chemicznej i opracowywaniu leków"
.Zapoznaj się z innymi produktami w naszym katalogu, które powstały we współpracy z profesorem Sharplessem na jego Professor Product Portal.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?