Immunomonitoring oparty na wielkości przy użyciu ręcznego licznika komórek Scepter™ 3.0
Wprowadzenie
Krążący ludzki układ odpornościowy, przedstawiony jako pojedyncza migawka w próbce krwi, składa się z wielu typów komórek o różnych profilach funkcjonalnych, które działają wspólnie w celu obrony organizmu przed inwazyjnymi patogenami. W rzeczywistości większość próbek biologicznych lub hodowanych komórek to heterogeniczne mieszaniny komórek, które różnią się typem, funkcją lub stanem zdrowia. Takie różnice w atrybutach komórkowych są najczęściej rozróżniane poprzez pomiar różnic w ekspresji markerów powierzchniowych za pomocą wieloparametrowej cytometrii przepływowej. Istnieje jednak wiele przypadków, w których typy lub stany komórek w próbce mogą się różnić, a tym samym być rozróżnialne na podstawie samego rozmiaru.
The Licznik komórek Scepter™ 3.0 łączy w sobie łatwość zautomatyzowanego oprzyrządowania z dokładnością opartej na impedancji zasady wykrywania cząstek Coultera w wygodnym, podręcznym formacie. Urządzenie wykorzystuje kombinację analogowego i cyfrowego sprzętu do wykrywania, przetwarzania sygnału, przechowywania danych i wyświetlania graficznego. Nowa konstrukcja licznika komórek Scepter™ 3.0 ma ulepszoną ergonomię ułatwiającą obsługę jedną ręką, większy ekran i bardziej intuicyjny interfejs użytkownika. Zużywalny czujnik mikroprzepływowy ma otwór w strefie wykrywania komórek, który umożliwia urządzeniu wykorzystanie zasady Coultera do rozróżniania wielkości i objętości cząstek z rozdzielczością odpowiednio submikronową i subpikolitrową. Czujnik został również przeprojektowany pod kątem łatwego mocowania i wysuwania za pomocą przycisku. Urządzenie jest również kompatybilne z WiFi® do bezprzewodowego przesyłania danych.
Licznik komórek Scepter™ 3.0, w połączeniu z czujnikiem o aperturze 40 μm, może dokładnie zliczać i precyzyjnie określać wielkość szerokiego zakresu typów komórek i cząstek. Niniejsza nota aplikacyjna przedstawia dwa przykłady eksperymentów wykorzystujących czułą zdolność licznika komórek Scepter™ 3.0 do rozróżniania wielkości w celu szybkiej oceny jakościowej poszczególnych populacji komórek w złożonym środowisku próbek PBMC.
Metody
Przygotowanie próbki ludzkiej krwi
Frakcje ludzkich PBMC zostały wyizolowane z pełnej heparynizowanej krwi zdrowych dawców za pomocą wirowania w gradiencie gęstości Ficoll® Paque. W skrócie, 10 ml krwi rozcieńczono w stosunku 1:3 solą fizjologiczną buforowaną fosforanami (PBS) i nałożono na 15 ml Ficoll. Próbki wirowano z prędkością 400 x g przez 30 minut bez hamowania. Powstałą warstwę PBMC odzyskano przez ostrożne pipetowanie i przemyto dwukrotnie PBS (1000 x g przez 8 minut). Po ostatnim wirowaniu, osady komórkowe zawieszono ponownie w RPMI 1640 uzupełnionym 10% płodową surowicą bydlęcą (FBS) (pożywka R10).
Hodowla komórek i aktywacja
Wszystkie eksperymenty hodowlane przeprowadzono w pożywce R10. PBMC (500 000/ml, płytki 24-dołkowe) stymulowano przez 2 dni w obecności rozpuszczalnego przeciwciała monoklonalnego anty-CD28 (2 μg/ml) na płytkach pokrytych wstępnie przeciwciałem monoklonalnym anty-CD3 (10 μg/ml). Stymulację mitogenną przeprowadzono w obecności fitohemaglutyniny (PHA, 0,5 - 5 μg/ml). Hodowle zostały pobrane do analizy po 24 i 48 godzinach od stymulacji.
Liczenie i określanie wielkości komórek Scepter™ 3.0
Licznik komórek Scepter™ 3.0 został użyty do liczenia próbek zgodnie z prostymi instrukcjami wyświetlanymi na ekranie dla każdego etapu procesu. Krótko mówiąc, użytkownik podłącza czujnik 40 μm, zanurza czujnik w próbce (probówka 1,5 ml) i naciska przycisk OK, aby pobrać próbkę. Następnie przez otwór czujnika pobierane jest 50 μL zawiesiny komórkowej. Licznik komórek Scepter™ 3.0 wykrywa każdą komórkę przechodzącą przez otwór, oblicza stężenie i wyświetla rozkład populacji próbki w postaci histogramu w funkcji wielkości (średnicy lub objętości). Po zakończeniu czujnik jest odłączany za pomocą przycisku EJECT.
Histogram może być dalej analizowany za pomocą wbudowanego Histogram Explorer. Dla każdej akwizycji wyprowadzane są dwa pliki danych (PNG, CSV); pliki można eksportować za pomocą pamięci USB lub bezprzewodowo za pośrednictwem sieci Wi-Fi®, jeśli są kompatybilne.
Liczenie PBMC i określanie podzbiorów za pomocą cytometrii przepływowej
W celu zliczenia PBMC, 10 μL każdej próbki zmieszano z 190 μL odczynnika ViaCount Guava® i inkubowano przez 5 minut w temperaturze pokojowej. Dane dotyczące liczby i żywotności komórek uzyskano na cytometrze przepływowym Guava® easyCyte™ HT przy użyciu oprogramowania ExpressPro™.
W celu określenia podzbiorów, 1 x 105 PBMC zawieszono ponownie w 100 μL PBS + 0,1% albuminy surowicy bydlęcej (BSA). Poszczególne podgrupy komórek rozróżniano poprzez barwienie następującą kombinacją fluorescencyjnie znakowanych przeciwciał: CD3-PE (komórki T), CD19-Alexa Fluor® 488 (komórki B), CD16/56-APC (komórki NK) i CD14-PE-Cy7 (monocyty). Do każdego barwienia dołączono pojedynczo zabarwione próbki i kontrole izotypowe, aby zapewnić prawidłową konfigurację urządzenia. Próbki inkubowano w temperaturze 4°C przez 30 minut, przemyto dwukrotnie PBS i ponownie zawieszono w 200 μL PBS. Pozyskano 5000 komórek/próbkę i przeanalizowano je zgodnie z wcześniejszym opisem.
W przypadku hodowli aktywowanych, pobrano porcję komórek zgodnie z opisem. Aby rozróżnić aktywowane frakcje, próbki wybarwiono anty-CD3-PE, anty-CD25-APC i anty-CD69-Alexa Fluor® 488; pozyskano i przeanalizowano zgodnie z wcześniejszym opisem.
Wyniki
Ilościowa dyskryminacja monocytów i limfocytów w świeżo wyizolowanych PBMC
Licznik komórek Scepter™ 3.0 rozróżnia cząsteczki wyłącznie na podstawie wielkości zgodnie z zasadą Coultera. Aby zbadać, czy urządzenie może być stosowane w analizie PBMC, najpierw staraliśmy się zrozumieć rozkład wielkości cząstek obecnych w tych heterogenicznych próbkach za pomocą cytometrii przepływowej.
Ilościowa dyskryminacja za pomocą cytometrii przepływowej
Izolaty PBMC składają się z żywych komórek (wielu podtypów), martwych komórek i szczątków. Żywotność i składniki szczątkowe mogą się znacznie różnić w zależności od właściwości właściwych dla źródła krwi, a także metod przechowywania i obchodzenia się z pochodzącą próbką krwi. Aby zrozumieć względną proporcję trzech typów cząstek, próbki zabarwiono dwukolorowym barwnikiem fluorescencyjnym i przeanalizowano za pomocą cytometrii przepływowej. Odczynnik ten jest w stanie odróżnić komórki żywotne od nieżywotnych na podstawie różnej przepuszczalności dla dwóch barwników wiążących DNA. Barwnik przepuszczalny dla komórek wybarwia wszystkie komórki jądrzaste; barwnik nieprzepuszczalny dla komórek jasno wybarwia obumierające i martwe frakcje komórek, podczas gdy szczątki pozostają niewybarwione.
Wyniki z reprezentatywnego testu przedstawiono na Rysunku 1A. W tym przykładzie ponad 97% komórek było żywotnych; znaleźliśmy > 95% żywotności dla wszystkich preparatów PBMC w tym badaniu. Histogramy na Rysunku 1B pokazują rozkład trzech klasyfikacji w funkcji rozproszenia do przodu (korelat wielkości oparty na przepływie). Żywe komórki stanowiły szczyt różniący się od tego zajmowanego przez mniejsze szczątki i martwe komórki. Widać również, że frakcja żywych komórek składa się z dwóch różnych rozmiarów, ale nakładających się typów komórek.

Rysunek 1.Reprezentatywne dane cytometrii przepływowej pokazujące rozróżnienie żywych komórek od martwych i szczątków na podstawie ich wielkości. (A) Frakcje żywych komórek (czerwony), martwych (różowy) i szczątków (niebieski) zostały zdefiniowane przy użyciu odczynnika ViaCount®. (B) Histogramy pokazują rozkład cząstek w każdej frakcji w funkcji wielkości (mierzonej przez rozproszenie do przodu).
Cztery główne typy komórek zajmują przedział PBMC: limfocyty T, limfocyty B, komórki NK i monocyty. Aby zbadać rozmieszczenie tych komórek w odniesieniu do wielkości, PBMC zostały wybarwione przeciwciałami fluorescencyjnymi specyficznymi dla każdego typu komórek (Rysunek 2). Wykresy punktowe potwierdziły definicję każdego typu komórek za pomocą odpowiedniego markera powierzchniowego. Rysunek 2C pokazuje, że w spoczynkowych PBMC komórki T, B i NK były ogólnie mniejsze (niższa wartość rozproszenia do przodu) niż monocyty CD14+. Odkrycia te sugerują, że przedział monocytów jest wyjątkowo odróżnialny od wszystkich innych limfocytów na podstawie samego rozmiaru.

Rysunek 2.Reprezentatywne dane z wielokolorowej analizy cytometrii przepływowej na ludzkich PBMC. (A) Wykres 2D - żywe komórki (czerwone) są odróżniane od szczątków/martwych komórek (zielone) na podstawie rozrzutu do przodu i na boki. Wykres histogramu przedstawia te same dane zdefiniowane przez rozproszenie do przodu. (B) Żywe komórki z (A) są podzielone na podgrupy na podstawie ekspresji CD3, CD19, CD16/56 i CD14. (C) Histogramy pokazują lokalizację czterech podzbiorów w odniesieniu do dwóch pików zdefiniowanych przez rozproszenie do przodu. Trzy główne podgrupy limfocytów zostały rozdzielone w mniejszym (niebieskim) piku, podczas gdy monocyty CD14+ są ograniczone do większego (różowego) piku.
Rozróżnianie ilościowe przy użyciu czujnika Scepter™ 3.0
Aby zbadać zdolność czujnika Scepter™ 3.0 40 μm do odróżniania limfocytów od monocytów, świeżo przygotowane próbki PBMC analizowano przy użyciu licznika komórek Scepter™ 3.0 i cytometrii przepływowej. Reprezentatywne wykresy histogramów przedstawiono na Rysunku 3. Trzy główne piki (szczątki, limfocyty i monocyty) można było rozróżnić na podstawie samego rozmiaru przy użyciu każdej z metod analizy. W sumie przeanalizowano siedem próbek PBMC (Tabela 1). Zgodnie z wcześniejszymi wartościami, średnie średnie średnice komórek wynosiły 7,52 ± 0,24 μm i 10,73 ± 0,34 μm odpowiednio dla limfocytów i monocytów. Zaobserwowano dość duży zakres względnego % dla dwóch podgrup, prawdopodobnie ze względu na różnice w stanie zdrowia dawcy i potencjalnie w przygotowaniu próbki. Jak pokazano, względny procent każdego podzbioru był dość spójny we wszystkich trzech metodach analizy, a wartości różniły się o mniej niż 10%. Należy zauważyć, że bramkowanie oparte na rozmiarze (na dowolnej platformie) podlega stronniczości w umieszczaniu, szczególnie w przypadku niewielkiego rozróżnienia między nakładającymi się populacjami.
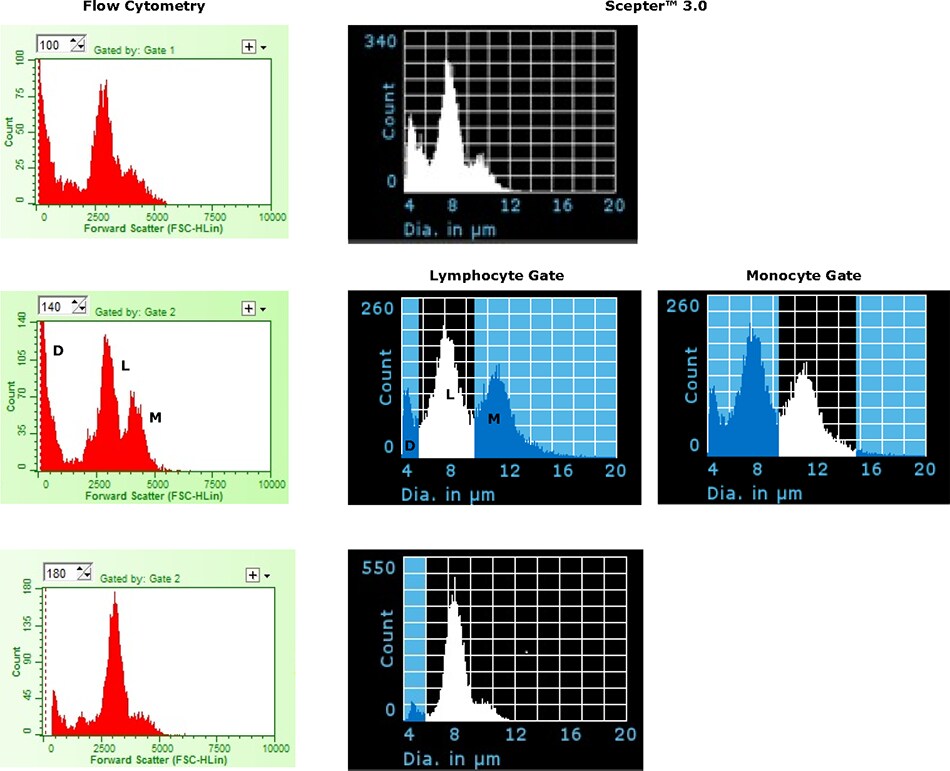
Rysunek 3.Reprezentatywne przykłady porównujące wykresy histogramów dla próbek ludzkich PBMC uzyskanych za pomocą licznika komórek Scepter™ 3.0 (średnica) i cytometrii przepływowej (rozrzut w przód). Wykresy pokazują trzy wyraźne piki odpowiadające frakcjom szczątków/martwych komórek (D), limfocytów (L) i monocytów (M). Dwa wykresy histogramu Scepter™ są pokazane dla środkowej próbki, aby zademonstrować funkcję bramkowania urządzenia.
Duży odsetek testów opartych na komórkach w zastosowaniach immunologicznych, w tym ELISpots i innych testów, w których odczyty oparte są na częstotliwości odpowiedzi, wymaga dokładnego określenia początkowej liczby komórek. Aby ocenić dokładność zliczania licznika komórek Scepter™ 3.0, próbki PBMC zostały ocenione w zakresie stężeń komórek. Jak widać na Rysunku 4A, licznik komórek Scepter™ 3.0 działał z wysoką liniowością w wielu próbkach przy różnych stężeniach początkowych (R2 > 0,99). Ponadto, w porównaniu z kapilarnym cytometrem przepływowym zdolnym do bezpośredniego zliczania komórek, obie platformy działały w przybliżeniu równoważnie podczas zliczania tylko komórek całkowitych lub limfocytów (Ryc. 4B i 4C). Ogólnie rzecz biorąc, odchylenie standardowe między powtórzeniami było znacznie niższe w przypadku licznika komórek Scepter™ 3.0 niż w przypadku cytometrii przepływowej; jest to prawdopodobnie spowodowane różnicą w pobieraniu próbek między dwiema platformami. Licznik komórek Scepter™ 3.0 pobiera próbki w oparciu o precyzyjny mechanizm pompy, podczas gdy próbki są ręcznie pipetowane na początku testu przepływowego.
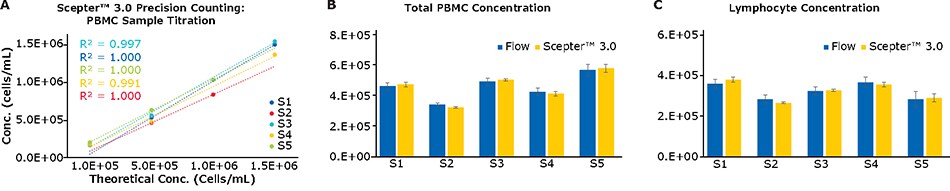
Rysunek 4.(A) Licznik komórek Scepter™ 3.0 działa z wysokim stopniem dokładności liniowej w całym zakresie próbek PBMC przy różnych wejściach komórek. (B, C) Dla tych samych próbek, oznaczanie stężenia komórek całkowitych i limfocytów zostało porównane z cytometrem przepływowym opartym na kapilarach. Konstrukcja ta nie wymaga osłony podczas pobierania próbki, umożliwiając w ten sposób bezpośrednie pomiary liczby komórek.
Jakościowe profilowanie aktywacji limfocytów
W odpowiedzi na bodźce antygenowe, komórki odpornościowe ulegają licznym zmianom fizycznym i funkcjonalnym, w tym zwiększeniu rozmiaru komórek, wydzielaniu cytokin i modulacji markerów powierzchniowych, takich jak CD69 i CD25. Testy mierzące zmiany w aktywacji limfocytów są powszechnie stosowane do identyfikacji wzorców odpowiedzi immunologicznej w diagnostyce klinicznej i projektowaniu terapeutycznym. W celu zbadania potencjalnego zastosowania licznika komórek Scepter™ 3.0 do szybkiego jakościowego monitorowania aktywacji komórek odpornościowych reprezentowanej przez wzrost wielkości komórek, świeżo wyizolowane PBMC były stymulowane w hodowli przy użyciu dwóch różnych mechanizmów: (1) ko-stymulacji receptora limfocytów T za pośrednictwem przeciwciał CD3/CD28 i (2) aktywacji mitogennej przez PHA.
Na Rysunku 5, zdolność licznika komórek Scepter™ 3.0 do wykrywania aktywacji komórek została porównana z analizą cytometryczną opartą na rozmiarze. Podczas gdy licznik komórek Scepter™ 3.0 był w stanie wykryć obecność większej, aktywowanej frakcji komórek, urządzenie miało ograniczoną zdolność do rzeczywistego rozróżniania komórek aktywowanych i niereagujących. Podobnie, cytometr przepływowy również nie był w stanie precyzyjnie zdefiniować dwóch stanów na podstawie samego rozmiaru; użycie markerów powierzchniowych (CD69+, CD25+) było wymagane do precyzyjnych oznaczeń ilościowych (dane nie pokazane). Podobna kwestia jest przedstawiona na Rysunku 6, gdzie nakładki histogramów są używane do jednoczesnego przedstawiania wielu próbek. Czynnikiem hamującym w obu przypadkach jest prawdopodobnie zwiększona obecność szczątków i martwych komórek, które nakładają się na dolny koniec frakcji żywych komórek. Oprócz aktywacji i wynikającej z niej zmiany wielkości komórek, stymulacja powoduje również szybką proliferację komórek aktywowanych i śmierć komórek niereagujących. Problem ten stanowi wyraźną demonstrację ograniczeń licznika komórek Scepter™ 3.0 i wszystkich innych metod analitycznych opartych na wielkości, w odniesieniu do ilościowej analizy podzbiorów.
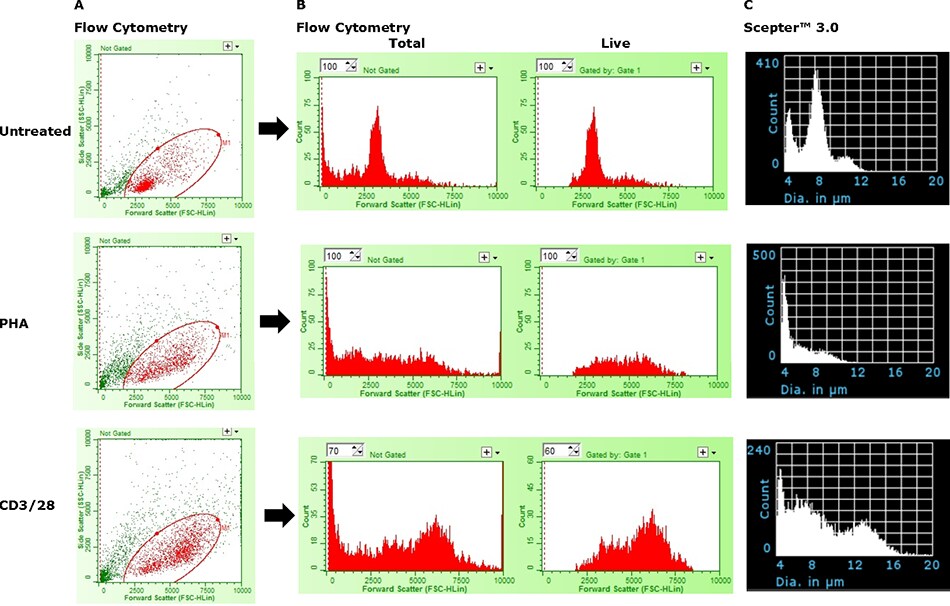
Rysunek 5.Ograniczenia licznika komórek Scepter™ 3.0 w bezwzględnym rozróżnianiu komórek aktywowanych i niereagujących. (A) Żywe komórki (czerwone) zostały odróżnione od martwych komórek i szczątków (zielone) przy użyciu odczynnika ViaCount™. (B) Dwa histogramy w każdym rzędzie pokazują względny rozkład zdarzeń całkowitych i żywych w funkcji wielkości cząstek (Forward Scatter). (C) Dane histogramu z tych samych próbek uzyskane na liczniku komórek Scepter™ 3.0 przy użyciu czujników 40 μm.

Rysunek 6.Nakładki histogramów (cytometria przepływowa - rozproszenie do przodu; Scepter™ 3.0 - średnica komórki) przedstawiające zmianę wielkości PBMC w odpowiedzi na stymulację. Gwiazdka (*) oznacza utrzymywanie się monocytów CD14+ w hodowlach nieleczonych i tych stymulowanych samym CD28 (określone przez barwienie powierzchni komórek, dane nie pokazane). Dane wskazują, że same metody analityczne oparte na wielkości nie są wystarczające do pełnej ilościowej analizy podzbiorów aktywowanych PBMC.
Podsumowanie
Ocena odpowiedzi immunologicznej na potencjalnie szkodliwe ekspozycje jest ważnym narzędziem w ocenie patogenności i toksyczności. Dostępność uproszczonych metod identyfikacji stanów aktywacji komórek i pomiaru różnic we względnych częstotliwościach wielu typów komórek w próbkach lub hodowlach mieszanych jest przydatna do przyspieszenia badań w tych dziedzinach. Przedstawiliśmy dane wskazujące, że licznik komórek Scepter™ 3.0 może ilościowo określać całkowitą liczbę komórek i podtypów komórek w świeżo wyizolowanych PBMC i hodowanych próbkach, jednak w przypadku aktywowanych próbek PBMC jednym z zastrzeżeń jest kwestia wysokiej zawartości zanieczyszczeń i / lub martwych komórek, co utrudnia dokładne rozróżnienie podgrup komórek w oparciu wyłącznie o pomiar wielkości. Cytometria przepływowa, dzięki mocy wieloparametrowej detekcji fluorescencyjnej, może przezwyciężyć te ograniczenia. Jednak znacznie bardziej wyrafinowane platformy wymagają znacznej konfiguracji, szkolenia i czasu, aby obsługiwać je z biegłością. W przeciwieństwie do tego, licznik komórek Scepter™ 3.0 jest wygodnym narzędziem, które może być używane w okapie do hodowli tkanek, aby zapewnić jakościowy wgląd w zdrowie komórek i odpowiedzi komórkowe w około 30 sekund.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?