Chromatografia cieczowa z oddziaływaniem hydrofilowym
Następne strony zawierają wprowadzenie do techniki separacji HILIC oraz przegląd strategii opracowywania niezawodnych metod separacji związków polarnych i hydrofilowych.
Czytaj więcej o
Co to jest HILIC?
Chromatografia cieczowa z oddziaływaniem hydrofilowym
HILIC lub Chromatografia cieczowa z oddziaływaniem hydrofilowym to technika wysokosprawnej chromatografii cieczowej (HPLC) służąca do rozdzielania związków polarnych i hydrofilowych. Pierwotnie technika separacji była nazywana "chromatografią z interakcją hydrofilową", a czasami używano również wyrażenia "wodna faza normalna".
Mówiąc prościej: HILIC jest typem separacji w fazie normalnej, ale wykorzystuje eluenty typu odwróconej fazy.
W ten sposób HILIC zapewnia:
- Kolumnę z hydrofilową fazą stacjonarną
- Eluent z wodą, buforem i wysokim stężeniem rozpuszczalnika organicznego mieszającego się z wodą.
Typowa aplikacja HILIC wykorzystuje acetonitryl w stężeniu 50-95% w buforze wodnym, takim jak mrówczan amonu, octan amonu lub ich kwasy, które mają wysoką rozpuszczalność w rozpuszczalnikach organicznych. HILIC może być stosowany z wieloma technikami wykrywania, ale w połączeniu na przykład ze spektrometrią mas z jonizacją elektrorozpyłową (ESI-MS), HILIC zapewni również wyższą czułość.
Odwrócona kolejność elucji w porównaniu do RPLC

Rysunek 1.Porównanie separacji peptydów w HILIC i RPLC.
Porządek elucji w HILIC jest mniej więcej odwrotny niż w RPLC (chromatografia cieczowa z odwróconymi fazami). Związek, który eluuje w pustej objętości na kolumnie RPLC, zwykle ma wysoką retencję w HILIC i odwrotnie.

Rysunek 2.HILIC wypełnia lukę w zestawie narzędzi chromatograficznych, ale także częściowo pokrywa się z technikami separacji RPLC, NPLC i IC.
Związki takie jak kwasy, zasady, jony, cukry i inne naładowane i neutralne związki hydrofilowe, które są kłopotliwe do rozdzielenia w RPLC, są znacznie łatwiejsze do rozdzielenia w HILIC ze względu na inną selektywność separacji. Niektóre związki można rozdzielić za pomocą więcej niż jednej techniki chromatograficznej, a HILIC pod tym względem częściowo pokrywa się zarówno z RPLC, NPLC (chromatografia cieczowa w fazie normalnej) i IC (chromatografia jonowa)
Dlaczego warto stosować HILIC?
Szybko rosnące zainteresowanie HILIC

Rysunek 3.Przykłady związków skutecznie rozdzielonych przy użyciu HILIC. Legenda: cholina (u góry po lewej), kwas askorbinowy (u góry po prawej), kwas p-toluenosulfonowy (u dołu po lewej) i risedronian (u dołu po prawej).
Technika separacji HILIC zyskuje duże zainteresowanie, ponieważ rozwiązuje wiele wcześniej trudnych problemów separacyjnych, w tym separację małych kwasów organicznych, leków zasadowych, kationów, anionów i wielu innych neutralnych i naładowanych substancji.
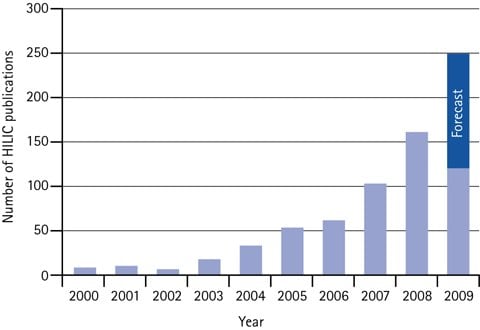
Rysunek 4.Roczna liczba artykułów naukowych na temat HILIC od 2000 r. do połowy 2009 r. oraz prognoza na 2009 r.
Przyjęcie metody HILIC spowodowało wykładniczy wzrost liczby cytowań w artykułach naukowych.
Nieatrakcyjne alternatywy>
Ze względu na solidność i powtarzalność obecnych związanych faz stacjonarnych RPLC, powszechną strategią było "ulepszenie" separacji RPLC w celu uwzględnienia również związków polarnych i hydrofilowych. Techniki stosowane w tym celu to chromatografia jonowa lub micelarna, polarne fazy osadzone i derywatyzacja. Te zwroty RPLC czasami były w stanie wykonać zadanie, ale są również nawiedzane przez szereg ograniczeń, takich jak; niska kompatybilność MS, niska stabilność fazy stacjonarnej i krwawienie z kolumny oraz czasochłonność z kilkoma zakłóceniami.
Solidna separacja związków hydrofilowych
HILIC jest najprostszą, wszechstronną i solidną techniką separacji związków polarnych i hydrofilowych w porównaniu z powyższymi opcjami. Dedykowane, związane fazy stacjonarne o wysokiej stabilności i powtarzalności są od kilku lat dostępne do separacji HILIC, przezwyciężając wszelkie wcześniejsze ograniczenia HILIC w stosunku do innych technik separacji. Na korzyść HILIC przemawia również dobra rozpuszczalność związków polarnych i hydrofilowych w eluentach HILIC zawierających wodę.
Czuła detekcja za pomocą LC-UV i LC/MS
Rozdzielanie HILIC można bardzo łatwo połączyć z kilkoma technikami detekcji, takimi jak absorbancja światła ultrafioletowego (UV), fluorescencja (FL), współczynnik załamania światła (RI), rozpraszanie światła przez odparowanie (ELSD), naładowany aerozol (CAD) i spektrometria masowa (MS).
Gdy HILIC jest używany z detekcją MS, czułość ESI będzie znacznie wyższa (10-100 razy) w porównaniu do RPLC. Wynika to z wysokiej zawartości rozpuszczalnika organicznego w fazie ruchomej, który obniża napięcie powierzchniowe, upraszczając w ten sposób tworzenie kropli podczas procesu rozpylania. Znacznie poprawia to tworzenie jonów w fazie gazowej, a tym samym czułość. Często przygotowanie próbki można uprościć i uczynić bardziej wydajnym, co skutkuje dalszym wzrostem czułości.
Orthogonality of HILIC
HILIC z RPLC to najbardziej ortogonalne połączenie
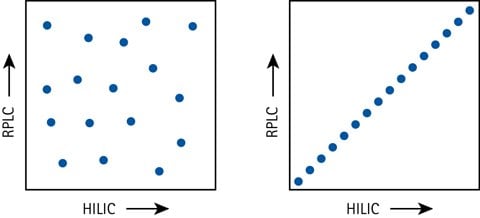
Rysunek 5.Ortogonalność separacji wyrażona schematycznie za pomocą HILIC i RPLC w przestrzeni separacji 2D - doskonała ortogonalność (po lewej) vs brak ortogonalności (po prawej).
Atrakcyjną cechą HILIC jest możliwość separacji 2D wraz z RPLC. HILIC-RPLC (lub odwrotnie) jest najbardziej ortogonalną kombinacją technik separacji cieczy, gdy ortogonalność jest definiowana jako frakcja pokrycia przestrzeni separacji 2D. Inne techniki, takie jak IC i SEC (chromatografia wykluczania), powodują większe grupowanie pików lub gorszą rozdzielczość w porównaniu z HILIC.
Więcej informacji z tej samej próbki
Korzyści z ortogonalności HILIC-RPLC można również wykorzystać, uruchamiając tę samą próbkę zarówno w trybie HILIC, jak i RPLC i łącząc dane. Zapewnia to więcej informacji na temat całej próbki (rysunek 7) i może być na przykład wykorzystane do ulepszonej identyfikacji białek poprzez przeszukiwanie baz danych lub do analizy odcisków palców próbki.

Rysunek 6.Więcej informacji z tej samej próbki dzięki połączeniu danych z HILIC i RPLC, tutaj na przykładzie trawienia tryptycznego BSA.

Rysunek 7.Proces podziału HILIC powodujący retencję chromatograficzną.
Obecna teoria HILIC mówi, że retencja HILIC jest spowodowana podziałem wstrzykniętych cząsteczek analitu pomiędzy eluent fazy ruchomej i warstwę wzbogaconą w wodę w hydrofilowej fazie stacjonarnej HILIC. Im bardziej hydrofilowy jest analit, tym bardziej równowaga podziału jest przesunięta w kierunku unieruchomionej warstwy wody w fazie stacjonarnej, co skutkuje większą retencją analitu.
Mechanizm wciąż dyskutowany
Chociaż dobrze wiadomo, że hydrofilowa powierzchnia zatrzymuje wodę po wystawieniu na działanie mieszanin rozpuszczalnika organicznego i wody, teoria podziału HILIC opiera się jedynie na poszlakach. Istnieją badania wskazujące na bardziej multimodalny mechanizm separacji, obejmujący wiązania wodorowe, a także oddziaływania dipol-dipol jako istotny wkład. Różnice w selektywności obserwowane dla różnych faz stacjonarnych HILIC również wskazują, że więcej niż jeden rodzaj interakcji jest odpowiedzialny za retencję chromatograficzną.
Na szczęście ten brak szczegółowego zrozumienia mechanizmu nie ogranicza skuteczności HILIC do separacji związków polarnych i hydrofilowych.
Regulacja retencji
Na retencję i selektywność w HILIC wpływa regulacja eluentu poprzez zmianę frakcji (i typu) rozpuszczalnika organicznego, stężenia (i typu) buforu oraz pH. Retencja wzrasta wraz ze wzrostem frakcji rozpuszczalnika organicznego i jest to najskuteczniejszy sposób dostrajania retencji.

Rysunek 8.Względne przybliżone znaczenie różnych czynników eluentu dla regulacji retencji w HILIC.
Bufor eluentu i pH wpływają na retencję zjonizowanych i jonizowalnych cząsteczek bardziej niż neutralnych, ponieważ zjonizowana cząsteczka jest bardziej hydrofilowa, a zatem jest silniej zatrzymywana w HILIC. Wpływ temperatury kolumny w separacjach HILIC jest często raczej niewielki (zwykle mniejszy niż w RPLC), ale ostatecznie zależy to od charakteru zatrzymywanej cząsteczki.
Więcej informacji na temat aspektów mechanizmu HILIC oraz wpływu różnych rozpuszczalników i rodzajów buforów na separację można znaleźć w broszurze "Praktyczny przewodnik po HILIC".
Fazy stacjonarne HILIC
There is More to HILIC than HILIC
.Ponieważ HILIC wymaga jedynie hydrofilowej powierzchni do adsorpcji i unieruchomienia warstwy wody w procesie podziału, kuszące może być założenie, że wszystkie hydrofilowe powierzchnie fazy stacjonarnej nadają się do HILIC i mają taką samą wydajność. Z pewnością tak nie jest! Ogólny ładunek, zależność od pH, zakres oddziaływań wtórnych i stabilność fazy mogą się znacznie różnić między różnymi typami faz stacjonarnych HILIC. Cechy te będą miały wpływ na selektywność separacji, a także na szansę powodzenia w opracowaniu solidnej metody HILIC.
Klasyfikacja faz stacjonarnych dla HILIC
Zasadniczo fazy stacjonarne HILIC można podzielić na trzy różne grupy - neutralne, naładowane i zwitterionowe:

Rysunek 9.Różne klasy faz stacjonarnych dla HILIC. Neutralne (góra), naładowane (środek) i zwitterionowe (dół).
Neutralny
- brak oddziaływań elektrostatycznych
- faza diolowa, faza amidowa
Naładowany
- silne oddziaływania elektrostatyczne
- faza krzemionkowa, faza aminopropylowasilne oddziaływania elektrostatyczne
- Fazy krzemionkowe, fazy aminopropylowe
Zwitterionic
- słabe oddziaływania elektrostatyczne
- SeQuant® ZIC®-HILIC ZIC®-HILIC i ZIC®-pHILIC
Dobre i złe interakcje wtórne<
W przypadku faz stacjonarnych, które zmieniają swoje właściwości w funkcji pH (takich jak zwykła krzemionka), istnieje złożona zależność między retencją a pH, co utrudnia przewidywanie i optymalizację separacji.

Rysunek 10.Retencja zasadowego i silnie dodatnio naładowanego peptydu bradykininy (pI=12) na różnych fazach stacjonarnych HILIC (zwykła krzemionka i zwitterionic) ilustrująca efekt zbyt silnych oddziaływań jonowych. Warunki: 40% acetonitryl w buforze octanu amonu (50 mM, pH 6,5).
Selektywność separacji między różnymi analitami może być wspierana przez oddziaływania elektrostatyczne (jonowe), które przyczyniają się do retencji w naładowanych fazach stacjonarnych HILIC. Przy zbyt silnych oddziaływaniach elektrostatycznych wymagane jest wysokie stężenie jonów soli w eluencie, aby zakłócić te interakcje w celu skutecznej elucji. Jest to niekorzystne, ponieważ wysokie stężenia soli lub buforu zmniejszają czułość w kilku technikach wykrywania - w tym MS. Równoważenie ładunku fazy stacjonarnej za pomocą związanego zwitterionu jest strategią projektową zastosowaną w kolumnach SeQuant® ZIC®-HILIC firmy Merck, aby uzyskać to, co najlepsze z obu światów.
Rozpuszczalniki dla eluentów HILIC
Acetonitryl i inne polarne rozpuszczalniki organiczne
Acetonitryl jest zwykle pierwszym wyborem jako składnik rozpuszczalnika organicznego do HILIC ze względu na dobrą mieszalność z wodą, dobrą retencję HILIC i niską lepkość. Jednak wiele innych polarnych rozpuszczalników organicznych, takich jak metanol, etanol, propanol, izopropanol, dioksan, aceton i DMF, może być również stosowanych jako rozpuszczalniki nieeliminujące w eluentach HILIC. Względna siła rozpuszczalnika w HILIC wynosi w przybliżeniu:
aceton < izo-propanol ~ propanol < acetonitryl < etanol < dioksan < DMF ~ metanol < woda
Kontrola retencji za pomocą rozpuszczalnika

Rysunek 11.Współczynnik retencji k jako funkcja stężenia acetonitrylu (symbole zamknięte) lub metanolu (symbole otwarte) jako modyfikatora organicznego w eluencie. Legenda; (trójkąty) cytozyna (kwadraty) adenina.
Najskuteczniejszym sposobem zmiany retencji w przypadku HILIC jest dostosowanie stężenia składnika rozpuszczalnika organicznego. W HILIC retencja wzrasta wraz ze wzrostem frakcji rozpuszczalnika organicznego.
Zauważono jednak, że zależność między współczynnikiem retencji (k) a frakcją rozpuszczalnika organicznego w fazie ruchomej nie jest zależnością logarytmiczną (co zwykle ma miejsce w RPLC). Zamiast tego zwykle obserwuje się zależność logarytmiczno-logarytmiczną. Praktyczną konsekwencją tego jest to, że gradienty HILIC powinny być płytsze, ponieważ retencja zmienia się bardziej przy niewielkiej zmianie stężenia rozpuszczalnika organicznego.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?