Wichtige Dokumente
11734334001
Roche
Protease-Universalsubstrat
lyophilized, suitable for detection, pkg of 40 mg (40 μmol; 100mM)
Synonym(e):
Casein, Resorufin-markiert, Proteasesubstrat, universal, Substrat für Protease
About This Item
Empfohlene Produkte
Form
lyophilized
Qualitätsniveau
Verpackung
pkg of 40 mg (40 μmol; 100mM)
Hersteller/Markenname
Roche
Konzentration
1 mg/mL
Anwendung(en)
detection
Versandbedingung
dry ice
Lagertemp.
−20°C
Verwandte Kategorien
Allgemeine Beschreibung
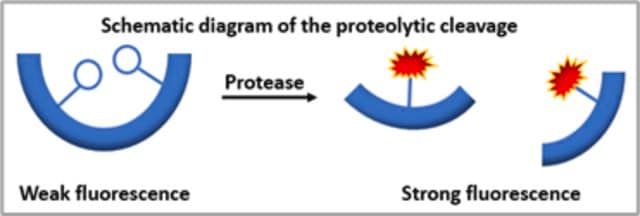
- Bequemer Nachweis von proteolytischen Aktivitäten im Nanogramm-Bereich in unter einer Stunde.
- Für die hochempfindliche Proteasedetektion in einem homogenen Assay.
Anwendung
Durch Behandlung mit Proteasen werden Resorufin-markierte Peptide von Resorufin-markiertem Casein freigesetzt. Sie können nicht durch Trichloressigsäure ausgefällt werden. Die Konzentration dieser Resorufin-markierten Peptide im Überstand ist äquivalent zur vorhandenen proteolytischen Aktivität.
Qualität
Angaben zur Herstellung
Lagerbedingungen (Arbeitslösung): -15 bis -25 °C
Eine wässrige Lösung ist bei -15 bis -25 °C mehrere Monate und bei 2 bis 8 °C 2 bis 3 Tage stabil. Es wird empfohlen, wässrige Lösungen in Aliquoten bei -15 bis -25 °C zu lagern. Wiederholtes Einfrieren und Auftauen ist möglich. Bei 15 bis 25 °C wird das Produkt in Lösung rasch hydrolysiert.
Sonstige Hinweise
Lagerklassenschlüssel
11 - Combustible Solids
WGK
WGK 2
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.