はじめに
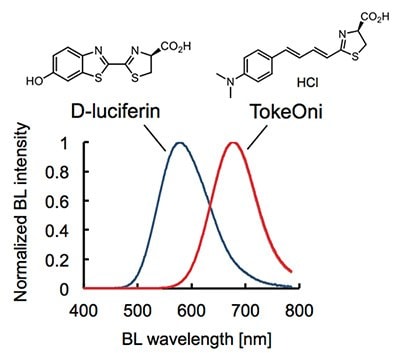
バイオルミネッセンス・イメージング(BLI)システムは、生体組織における細胞増殖、シグナル伝達経路の活性、タンパク質間相互作用の高感度かつ非侵襲的なモニタリング ができることから、この10年程の間に、生物医学研究において応用が急速に拡大しました1-3。しかし、現在のBLIシステムのボトルネックの1つは、ホタルルシフェラーゼ(Fluc)とその天然基質であるD-ルシフェリンを用いた標準的な組み合わせでは生物発光の波長が比較的短く(λmax = 560 nm)、生体組織で吸収・散乱されやすいことです。4,5。この問題を解決するために、近赤外(NIR)生物発光を利用したBLIシステムの開発が望まれていました。
TokeOni(AkaLumine-HCl、製品番号:808350)は、1)良好な化学的安定性、2)高い溶解性、3)野生型Flucによる近赤外生物発光(λmax = 677 nm)を実現した世界初の実用的な発光基質です。TokeOniは、ネイティブFlucを用いた現行のBLIシステムと高い互換性があり、特に生体深部におけるターゲットの検出感度に優れています6。
Tokeoniを用いた深部組織の高感度イメージング
TokeOniは、滅菌水(バッファーではない)に40 mMまでの高濃度で溶解し、-80℃において長期間(< 3ヶ月)保存可能であり、ATP-Mgの存在下で、野生型Flucと反応して近赤外生物発光(λmax = 677 nm)を発します(図1)。
TokeOniを用いた 高感度発光イメージングの例として、マウス骨転移モデルにおけるがん細胞の検出感度をD-ルシフェリンと比較した例を示します。SCIDマウスに、Flucを安定的に恒常発現するヒト前立腺がん細胞PC-3(PC-3/luc)を動脈内注射し、骨転移を形成させました。100 μLの基質(濃度33 mM:〜50 mg/body)を4時間の間隔をあけて、同じマウスにそれぞれ腹腔内投与し、PerkinElmer社のIVIS-Spectrumを用いて生物発光イメージを取得しました。図2に示したように、TokeOniは、後脚と腸骨の同一の骨転移病巣からD-ルシフェリンに比べて5.2倍強いシグナルを生成し、生体組織深部のがん細胞をより高感度に検出することができました。

図2.TokeOniによる骨転移がん細胞の高感度イメージング。D-ルシフェリン(D-luci)とTokeOniを投与して10分後に撮像した代表的な発光イメージ(左)と後肢骨転移病巣からの発光強度の定量的な解析結果(右)を示した。D-ルシフェリンを注射した4時間後に同じマウスにTokeOniを注射した。n=6、*p<0.05。<0.05.
TokeOniは通常、腹腔内投与すると、D-ルシフェリンよりも短時間で生物発光のピークを示す傾向があります。そのため、イメージングを行う前に、予めTokeOniのi.p.注射後の生物発光のピークタイムをマウスモデルで見つける必要があります。また、TokeOniを用いてin vitroでのチューブアッセイをおこなう場合は、使用するルミノメーターが近赤外光に十分な検出感度を有しているか確認する必要があります。
まとめ
TokeOniは、D-ルシフェリンを用いた深部組織におけるイメージングで検出できなかった、より少量の細胞を観察するための優れた選択肢の一つです。TokeOniによる検出感度が向上によって、生体内のターゲットをより正確に定量的に検出することが可能となります。
Network error: Failed to fetch
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?