フラッシュナノ沈殿(FNP)—医療用イメージング及び薬物送達における原理及び応用
Leon Z. Wang, Robert K. Prud’homme*
Department of Chemical and Biological Engineering, Princeton University, Princeton, New Jersey, US
Material Matters™, 2020, 15.3
はじめに
フラッシュナノ沈殿(Flash NanoPrecipitation, FNP)の原理は、急速な混合と沈殿工程によって高充填ナノ粒子を作製する新たな方法としてJohnsonとPrud’hommeによって2003年に初めて報じられました1。FNP技術はその後成熟を遂げ、薬物のカプセル化から農薬の送達までさまざまな分野に影響を与えています。FNPは、核形成、凝集及び安定化という各段階のタイムスケールが異なることをうまく利用したスケーラブルな混合工程です。最も基本的な形では、高疎水性分子と両親媒性ポリマーを水に混和する有機溶媒に溶解します。次いでこの有機液流を、特別に設計した乱流混合チャンバを用いて水性貧溶媒液流と急速に混合します。この混合中に、(1)疎水性活性物質の核形成及び凝集、および(2)立体的安定化するポリマーの凝集体への吸着とこれによる成長の停止、という競合する動的過程が進行していきます。活性物質とポリマーの比によって粒子サイズが制御され、ポリマーが不足するとナノ粒子は大きく成長しすぎ、安定化ポリマーが過剰であればミセルが形成される場合があります。混合強度の閾値(レイノルズ数、Re)ないしはそれ以上では、ナノ粒子成長時間よりも混合時間が短くなり、ナノ粒子サイズはもはや流速に依存せず液流の組成にのみ依存します2。混合の鍵は乱流で、これはスケーラブルであり、本質的にレイノルズ数が低くなるマイクロ流体デバイスでの流れとは根本的に異なります。
ミキサーの進化とスケーラビリティ
当初のミキサーのデザインは、運動量の等しい2つの対向流が円筒型の混合体積内で衝突するというものでした。この手持ちのシリンジ又はシリンジポンプを用いて対向流を形成するタイプの拘束衝突噴流(CIJ:confined impinging jet)ミキサーでは、迅速なスクリーニングや製剤開発のための小さなバッチが製造可能です(図1)。形成後のナノ粒子サイズの安定性はオストワルド熟成による成長の速度に依存し、これは溶液相中の活性物質の溶解性に依存します3。CIJミキサーは等しい流速を必要とするため、結果的に溶媒:貧溶媒比は1:1となります。貧溶媒比はCIJの生成物を反応停止槽に回収することで低下することから、結果的に活性物質の溶解性も低下します。我々は通常、最終的な溶媒濃度が10%となるように反応停止槽の容積を決定しています。Liuらは、タンジェンシャル乱流を用いて4つの混合流を形成する新しいミキサーデザインを開発しました(図1)。マルチインレットボルテックスミキサー(MIVM)と呼ばれ、MIVM内の各液流が独立してマイクロ混合工程に寄与します4。

図1様々なスケールでのFNP工程の略図。(左)CIJミキサーでは、製剤の処方をスクリーニングするため多数の小さなバッチを素早く連続して合成できます。(右)MIVMでは処方をスケールアップし、ナノ粒子溶液をリットル単位で製造することができます。[レイノルズ数(Re)の式は参考文献1及び4に記載]。
CIJミキサーとは異なり、MIVMでは液流の運動量を合わせる必要がないため、ナノ粒子製剤の設計自由度が高くなります。例えば、2つの異なる有機溶媒を別々の液流に使用し、それぞれ異なる医薬品有効成分(active pharmaceutical ingredient, API)を含有させることができます。また、混合工程で有機成分が十分に希釈された場合には、反応停止槽は必要なくなるため、真に連続的なナノ粒子製造工程を確立できます。Markwalterらは、ナノ粒子のバッチあたりに要する材料が少ないスケールダウン版を開発することで、MIVMのデザインを拡大しました5。スケールが異なる混合装置間での比較実験において、混合強度が十分であれば粒子のサイズと特性に大きな違いは見られませんでした6。また、MIVMミキサーとCIJミキサーを比較した結果、Re数の閾値を超えていればナノ粒子サイズ及び分布は同一でした(図2B)。MIVM及びCIJを用いて調製したナノ粒子の動的光散乱(DLS:dynamic light scattering)トレース及びTEM画像でも、粒子サイズや特性に違いは認められません(図2A、2C、2D)6。すなわち、スクリーニング及びスモールスケールの製剤にはCIJミキサーを使用し、その後のスケールアップにMIVMを使用するというシームレスな開発が可能です。大スケールのMIVMとしては、現在WuXi AppTec(上海)において300 Lのバッチサイズ及び2 L/分の速度で抗マラリア薬の250 nmナノ粒子が製造されています。

図2CIJ及びMIVMにより調整したナノ粒子の比較。A)ビタミンE酢酸塩コアとPS-b-PEG安定剤で調製したナノ粒子のDLSトレース。ナノ粒子サイズはミキサーの種類には依存しません。B)CIJ及びMIVMによる調製での混合のレイノルズ数に対する相対ナノ粒子サイズのプロット。レイノルズ数が閾値である50,000を上回っていれば、ナノ粒子サイズは流速に影響されません。C、D)CIJ及びMIVMナノ粒子のTEM画像では、2種類のミキサーで調製したナノ粒子間に大きな違いはありません。
安定化剤の選択
前述のとおり、両親媒性安定化剤はナノ粒子調製において重要な役割を果たします。FNPの初期スクリーニングにおいては、一般に非分解性のブロックコポリマーが用いられます。ポリスチレン-block-ポリエチレングリコール(PS-b-PEG)は多くの用途で汎用性の高い安定化剤です。ナノ粒子に組み込むと、親水性PEG鎖が疎水性コアの周囲に高密度のコロナ状の外層を形成します。この高密度のPEG鎖によって、長い循環期間や粘膜通過などの好ましい生物学的特性が得られます7。PEGコポリマーの一部又は全部をポリアクリル酸(PAA)又は2-(ジメチルアミノ)エチルメタクリレート(DMEMA)に代えると、ナノ粒子はそれぞれ正及び負の表面電荷を帯びます。表面電荷はナノ粒子の生体内分布及びクリアランスに影響するため、表面電荷の調整は特定の対象組織にナノ粒子を標的化するのに役立ちます。生分解性ナノ粒子を必要とする用途では、ポリスチレンブロックをポリ乳酸(PLA)又はポリカプロラクトン(PCL)に代えることができます8,9。これらのポリマーの加水分解により、ナノ粒子からの緩徐で持続的な薬剤放出及び最終的なクリアランスが可能となります。一般に使用されるブロックコポリマー安定化剤の化学構造を図3に示します。保健・医療分野へ幅広く適用するには、製造コストの観点から低コストな材料を使用する必要があります。こうしたシステムでは、ヒドロキシプロピルメチルセルロースアセテートスクシネート(HPMC-AS)、レシチン、ゼイン、カゼインなど、より安価な安定化剤が使用できます10。

図3FNPで使用する標準的なポリマー安定化剤。比較的安価なポリスチレン系ブロックコポリマーA、B、Cは、一般に試作や生体外の用途に使用されます。生分解性コポリマーD、Eは、治療用途に使用されます。
経口デリバリー製剤への応用
FNPの応用の1つとして、APIのバイオアベイラビリティを高めるための疎水性薬剤のカプセル化があります。クロファジミン(CFZ:Clofazimine)は疎水性分子で、当初ハンセン病の治療に用いられていましたが、発展途上国における下痢の主な原因であるクリプトスポリジウム感染症に対しても有効であることが近年判明しています。しかし、CFZはそのままでは消化管内での溶出速度が遅いという問題があるため、クリプトスポリジウムに対して必要な即効性の治療には適しません。FNPはこの問題を解決可能で、CFZの溶解性を高めるとともに溶出性も向上させることができます。FNPの急速沈殿及び安定化工程によってカプセル化することにより、疎水性活性分子を非晶質の状態で捕捉し保持することができます。また、FNPナノ粒子はサイズが小さいため比表面積が高くなり、そのため薬剤の溶出速度が高まります。これら両方の要因がCFZの溶解性及び経口バイオアベイラビリティの改善につながります。Zhangらは、さまざまな低コストの安定化剤を使用し、非常に高い封入率(92%超)でCFZをナノ粒子に封入しました10。ナノ粒子に封入することで、噴霧乾燥又は凍結乾燥でナノ粒子を乾燥粉末に加工した後でもCFZの非晶質状態が保存されていることが、DSC曲線から確認することができます(図4A)。人工胃液及び腸液中でインキュベートしたとき、6時間後にCFZナノ粒子は50~90倍高い過飽和濃度及び完全な溶出を示しました。Fengらは、FNPによってCFZ以外のAPIも非晶質状態を安定化して溶出性を向上させることができることを示しました11。ルメファントリン(LMN:Lumefantrine)は、マラリアの治療に有効な疎水性APIですが、クロファジミンと同様に消化管内でのバイオアベイラビリティと吸収性の低さが難点です。この研究では、低コストの天然ポリマーを用いてLMNをナノ粒子に封入しました。前述したCFZでの研究と同様、FNPによってLMNの結晶化が抑えられ、人工腸液中での溶出性が2桁程度向上しました(図4B)。この非晶状態のナノ粒子では摂取時腸液と空腹時腸液の間の差も減少しました。ナノ粒子製剤とすることで、同じAPIを従来型の噴霧乾燥して作製した分散体と比較して、高温や湿度など周囲の環境の条件に対して放出挙動が影響されにくくなります12。

図4経口治療薬封入へのFNPの応用。A)3種類のクロファジミンナノ粒子製剤のDSC曲線。CFZ粉末は22℃に結晶化のピークを示すのに対して、ナノ粒子製剤はCFZを非晶質状態に保持できます。B)人工胃液中におけるLMN製剤の薬剤放出アッセイ。ナノ粒子では2時間後にほぼ完全に放出されたのに対し、LMN粉末では溶液中の薬剤が1%未満です。<1% drug in solution.
医療用イメージングへの応用
医療診断において、特定の部位の画像をより高感度に得るために造影剤が頻繁に使用されています。PET用のFDG(フルオロデオキシグルコース)など一般的に使用される造影剤は、患者に直接注入するため水溶性でなければなりません。FNPに非水溶性化合物を封入することで、これまでは使用できなかったさまざまな疎水性の造影剤が利用できるようになります。さらに、FNPプロセスは高充填ナノ粒子の作製に威力を発揮し、これによりナノ粒子コアの造影剤濃度は高まり撮像感度が大幅に向上します。一例として、PS-b-PEG安定化剤を用いてフタロシアニン系色素がコア充填率35%で封入されています13。このように高いコア濃度のナノ粒子は、造影剤を用いた光音響イメージングに使用できます。Luらは光音響イメージングを用いて、マウス腫瘍モデルにおけるナノ粒子の生体内分布を検討しています14。有機色素のシャープで明瞭な吸収スペクトルのために多重イメージングが可能となり、波長ごとのシグナルをデコンボリュートすることで複合画像が生成されています。この技術を用いることで、ナノ粒子と酸素化/脱酸素化血の両方のシグナルが同時に可視化できます(図5A)。図5Bに示すとおり、より一般的な蛍光画像診断で生体内分布を追跡することもできます。この蛍光ナノ粒子を含有するゲルマイクロ粒子の画像から、サイズによって肺におけるマイクロ粒子の捕捉挙動が決定されることがわかります。Pinkertonらは酸化鉄系ナノ結晶(IONC:iron oxide-based nanocrystal)を封入することにより、FNPの診断への応用をMRIにも拡げました15。強力なT2 MRIシグナルはIONCのサイズ及び密度に大きく依存するため、25%wtに至る充填率でIONCの微小なクラスタを封入したナノ粒子を、一段階でのFNPによって調製しました。肝マクロファージによる取込みを効率化するために、末端が水酸基のPS-b-PEGを安定化剤に用いられました。NSCLC同所性移植マウスモデルにおいて、これらのIONCナノ粒子により肝臓のMRIコントラストが強調され、他の方法では検出されない腫瘍転移が検出されました(図5C)。

図5FNPナノ粒子の生体イメージングへの応用。A)マウスモデルの光音響トモグラフィーを用いた多重イメージングにより、皮膚でのナノ粒子の蓄積が認められます(緑色)。酸素化及び脱酸素化血も可視化されます(それぞれ赤色及び青色)。B)色素封入ナノ粒子の蛍光。このナノ粒子を含有する生分解性マイクロ粒子をマウスに注入しました。より小さな粒子は肝臓に蓄積していたのに対し、より大きな粒子は肺に検出されました。C)酸化鉄系ナノ結晶(IONC)封入ナノ粒子を用いたマウス腫瘍モデルにおける肝転移のMRI画像。黄色の線はIONCナノ粒子注入前後の肝転移の位置を指します。ナノ粒子は健常組織内に存在し(黒色を呈している)、転移がより明確に可視化されるようにコントラストが生じています。D)111In標識ナノ粒子のSPECT画像で、生体内分布及びクリアランスの経時変化がみられます。
放射性トレーサーPET又はSPECTイメージングを使用すれば感度及び画像の解像度がさらに高まります16。これらのトレーサーを迅速かつ効率的に「充填」できるナノ粒子の合成が必要です。1つの方法として、安定化剤の親水性末端にキレート分子を結合することがあります。これらのキレート剤に放射性トレーサーを捕捉して、SPECT/PET活性化ナノ粒子を形成することができます。SPECTの研究では、111Inをキレート化するためにDPTA(ジエチレントリアミン五酢酸)を結合したPS-b-PEGを使用しました。これらのナノ粒子を用いて薬物動態試験を行い、ナノ粒子のクリアランス機構及びクリアランス速度を定量しました(図5D)。より最近ではLuらが、表面に結合させるよりも有効なPETを可能とする、PEGコートしたナノ粒子を64Cuで放射標識する方法を報告しました。フタロシアニン系金属キレート剤の封入が最初に起こり、非常に疎水性のフタロシアニンがナノ粒子のコアに充填されます。その後、PET活性な64Cuをコア内に充填することでナノ粒子は「PET活性化」されます。この工程は、迅速かつ直接的なインキュベーションによって行われます17。このコア放射性標識では、ナノ粒子表面に露出したキレート剤で起きえるオフターゲット効果が最小限に抑えられます。
特定の細胞型に対する標的化への応用
目的の臓器または細胞型に対するナノ粒子の標的化効率が高まれば、治療法の有効性及び診断用イメージングの感度がいずれも向上します。これは、ナノ担体の外側に標的化リガンドを付けることによって達成されます。これらの標的化リガンドには、標的細胞上の受容体に特異的に結合する抗体、ペプチド、糖、低分子などがあります。一例として、マンノシド結合ナノ粒子がJ774Eマクロファージのマンノース受容体に特異的に結合することが示されています(図6A)18。このような抗原提示細胞に対して特異的に結合させる方法は、ナノ粒子を用いたワクチンの可能性を広げるでしょう。癌治療の分野では、KB腫瘍細胞への局在を可能にする葉酸標的化ナノ粒子の調製にFNPが使用されています(図6B)。ヤンセンファーマとの共同研究において、Eliasらは、センチリンと呼ばれるヒトコンセンサスフィブロネクチンドメインに基づく足場タンパク質もナノ粒子標的化療法に使用できることが示しています。EGFR標的化センチリンをPS-b-PEGナノ粒子上に官能基化したところ、HER2乳癌細胞への局在に成功しました(図6C)。
多くの研究では最初にナノ粒子を調製してからナノ粒子表面を修飾するのに対し、標的化リガンドを安定化剤ポリマーに直接反応させることにより、ナノ粒子調製前にも官能基化を行うことができます。FNP前にポリマーを修飾することで、ナノ粒子表面の官能基化率が正確に定量できます。さらに、FNP中に修飾したポリマーを既知量の未修飾ポリマーと合わせることにより、表面の官能基化量を調整できます。一例として、黄体形成ホルモン放出ホルモン(LHRH)をPS-b-PEGポリマー末端に結合し、これを用いて官能基化率がさまざまに異なるFNPナノ粒子が調製されています19。In vitroの実験により、MS578T乳癌細胞によるナノ粒子の強い取込みが示されました(図6D)。
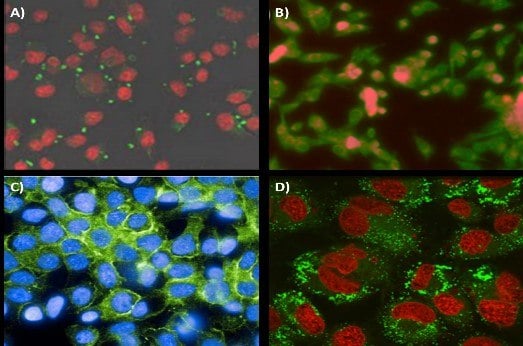
図6FNPナノ粒子の標的化への応用。A)J774Eマクロファージのマンノース受容体へのマンノシド標的化ナノ粒子の局在。ナノ粒子の外層PEGコロナにマンノシドを結合。ナノ粒子は緑色、細胞は赤色に可視化されています。B)KB腫瘍細胞株を標的とした葉酸結合ナノ粒子。ナノ粒子の蛍光は赤色に、細胞は緑色に染色されています。C)HER2細胞株のEGFR受容体を標的としたセンチリン足場。D)黄体形成ホルモン放出ホルモン(LHRH)を表面に結合した80 nmナノ粒子のMS578T乳癌細胞への取込み。ナノ粒子及び細胞がそれぞれ緑色及び赤色に可視化されています。
水溶性活性物質のカプセル化への応用
FNPはlog Pが5を超える疎水性APIのカプセル化に適していますが、これより疎水性の低い多くの薬剤もカプセル化することができます。現在、FNPによって親水性APIをカプセル化するために、2つの方法が研究されています。逆フラッシュナノ沈殿(iFNP:inverse Flash NanoPrecipitation)では、有機貧溶媒の液流を用いて親水性活性物質を沈殿させます。従来型のFNPナノ粒子とは異なり、この「逆」ナノ粒子では、疎水性末端が外側に、親水性末端が内側に向いています。次のFNPコーティング工程でiFNPナノ粒子に親水性ポリマーをコートし、水相に移行させます(図7A)20。親水性APIをカプセル化するもう1つの方法は、疎水的イオン対の形成(HIP:hydrophobic ion pairing)です。親水性APIと静電的に対合する対イオンによって荷電基を効果的に打ち消すことで、得られるイオン対はFNP中に沈殿するようになります。Gindyらはこの方法を利用して、カチオン性脂質とのイオン対を形成することで、70%を超える効率でsiRNAをカプセル化しました(図7B)21。HIPによるペプチド及び低分子APIのカプセル化については、Ristrophらの総説があります22。

図7親水性活性物質のカプセル化。A)iFNPの手順。有機貧溶媒と混合することにより、生物活性物質又は別の親水性活性物質が沈殿します。得られた逆ナノ粒子に第二のポリマーをコートし、水分散性のナノ粒子を生成します。参考文献20から許可を得て転載(copyright 2014 ACS Publishing)。B)静電相互作用を用いたsiRNAのカプセル化。カチオン性脂質によりアニオン性siRNAを中和することで、カプセル化率が非常に高いsiRNAナノ粒子が生成されます。参考文献21から許可を得て転載(copyright 2019 Royal Society of Chemistry)。
結論
ナノ医療は製剤技術や治療法の進歩とともに絶え間なく変化しています。FNPプラットフォームは小規模のラボレベルでの研究サンプルを作製する技術でありながら、大規模な商業生産へと簡単に移行できます。本法は、疎水性活性物質から、イオン対の形成により疎水化した可溶性活性物質、および逆FNPを用いる可溶性オリゴヌクレオチド、ペプチド、タンパク質まで、広範な活性物質に適用できます。プラットフォーム技術としてのFNPも絶えず進化しており、用途の拡大とともにプロセス自体の改良が行われています。本稿では生物医学的応用における一部の例のみを示しましたが、ナノ粒子を用いた治療法及び診断法のさらなる革新への扉が開くことが期待されます。FNPナノ粒子調製のためのCIJ及びMIVMミキサーの操作に関するビデオチュートリアルが公開されています23。
Network error: Failed to fetch
Network error: Failed to fetch
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?